Образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по .
Комплексообразователь - центральный атом комплексной частицы. Обычно комплексообразователь - атом элемента , образующего металл , но это может быть и атом кислорода , азота , серы , йода и других элементов, образующих неметаллы . Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром ; заряд комплексообразователя может быть также отрицательным или равным нулю.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью), бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три- , тетрадентатные и т. д.
Координационный полиэдр - воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах - частицы лигандов, непосредственно связанные с центральным атомом.
Тетракарбонилникель
- дихлородиамминплатина(II)
По числу мест, занимаемых лигандами в координационной сфере
1) Монодентатные лиганды . Такие лиганды бывают нейтральными (молекулы Н 2 О, NH 3 , CO, NO и др.) и заряженными (ионы CN − , F − , Cl − , OH − , SCN − , S 2 O 3 2− и др.).
2) Бидентатные лиганды . Примерами служат лиганды: ион аминоуксусной кислоты H 2 N - CH 2 - COO − , оксалатный ион − O - CO - CO - O − , карбонат-ион СО 3 2− , сульфат-ион SO 4 2− .
3) Полидентатные лиганды . Например, комплексоны - органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота - ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда
1) Аммиакаты - комплексы, в которых лигандами служат молекулы аммиака , например: SO 4 , Cl 3 , Cl 4 и др.
2) Аквакомплексы - в которых лигандом выступает вода : Cl 2 , Cl 3 и др.
3) Карбонилы - комплексные соединения, в которых лигандами являются молекулы оксида углерода(II) : , .
4) Ацидокомплексы - комплексы, в которых лигандами являются кислотные остатки . К ним относятся комплексные соли: K 2 , комплексные кислоты: H 2 , H 2 .
5) Гидроксокомплексы - комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na 2 , Na 2 и др.
Номенклатура
1) В названии комплексного соединения первым указывают отрицательно заряженную часть - анион , затем положительную часть - катион .
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды - анионы, прибавляя к их латинскому названию окончание «о». Например: Cl − - хлоро, CN − - циано, SCN − - тиоцианато, NO 3 − - нитрато, SO 3 2− - сульфито, OH − - гидроксо и т. д. При этом пользуются терминами: для координированного аммиака - аммин, для воды - аква, для оксида углерода(II) - карбонил.
(NH 4) 2 - дигидроксотетрахлороплатинат(IV) аммония
[Сr(H 2 O) 3 F 3 ] - трифторотриаквахром
[Сo(NH 3) 3 Cl(NO 2) 2 ] - динитритохлоротриамминкобальт
Cl 2 - хлорид дихлоротетраамминплатины(IV)
NO 3 - нитрат тетрааквалития
История
Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1866-1919). Координационная теория Вернера 1893 года была первой попыткой объяснить структуру комплексных соединений. Эта теория была предложена до открытия электрона Томсоном в 1896 году, и до разработки электронной теории валентности . Вернер не имел в своём распоряжении никаких инструментальных методов исследований, а все его исследования были сделаны интерпретацией простых химических реакций .
Представления о возможности существования «дополнительных валентностей», зародившиеся при изучении четвертичных аминов , Вернер применяет и к «комплексным соединениям». В статье «К теории сродства и валентности», опубликованной в 1891 г., Вернер определяет сродство как «силу, исходящую из центра атома и равномерно распространяющуюся во всех направлениях, геометрическое выражение которой, таким образом, представляет собой не определённое число основных направлений, а сферическую поверхность». Два года спустя в статье «О строении неорганических соединений» Вернер выдвинул координационную теорию, согласно которой в неорганических молекулярных соединениях центральное ядро составляют комплексообразующие атомы. Вокруг этих центральных атомов расположено в форме простого геометрического полиэдра определённое число других атомов или молекул . Число атомов, сгруппированных вокруг центрального ядра, Вернер назвал координационным числом . Он считал, что при координационной связи существует общая пара электронов , которую одна молекула или атом отдает другой. Поскольку Вернер предположил существование соединений, которые никто никогда не наблюдал и не синтезировал , его теория вызвала недоверие со стороны многих известных химиков, считавших, что она без всякой необходимости усложняет представление о химической структуре и связях. Поэтому в течение следующих двух десятилетий Вернер и его сотрудники создавали новые координационные соединения, существование которых предсказывалось его теорией. В числе созданных ими соединений были молекулы, обнаруживающие оптическую активность , то есть способность отклонять поляризованный свет, но не содержащие атомов углерода , которые, как полагали, были необходимы для оптической активности молекул.
В 1911 г. осуществление Вернером синтеза более чем 40 оптически активных молекул, не содержащих атомов углерода, убедило химическое сообщество в справедливости его теории.
В 1913 г. Вернеру была присуждена Нобелевская премия по химии «в знак признания его работ о природе связей атомов в молекулах, которые позволяли по-новому взглянуть на результаты ранее проведённых исследований и открывали новые возможности для научно-исследовательской работы, особенно в области неорганической химии ». По словам Теодора Нордстрема, который представлял его от имени Шведской королевской академии наук, работа Вернера «дала импульс развитию неорганической химии», стимулировав возрождение интереса к этой области после того, как она какое-то время пребывала в забвении.
Структура и стереохимия
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером , лауреатом Нобелевской премии . Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом . Внутреннюю сферу составляет определённое число ионов или нейтральных молекул , которые прочно связаны с комплексообразователем. Их называют лигандами . Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу .
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы. Таким нейтральным комплексом является, например, .
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой - между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония . Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения , так и связью, образующейся за счёт неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы.
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава.
Наиболее типичными комплексообразователями являются катионы d-элементов. Лигандами могут быть:
а) полярные молекулы - NH 3 , Н 2 О, CO, NO;
б) простые ионы - F − , Cl − , Br − , I − , H + ;
в) сложные ионы - CN − , SCN − , NO 2 − , OH − .
Для описания взаимосвязи пространственного строения комплексных соединений и их физико-химических свойства используются представления стереохимии . Стереохимический подход - удобный прием представления свойств вещества в части влияния того или иного фрагмента структуры вещества на свойство.
Объекты стереохимии - комплексные соединения, органические вещества , высокомолекулярные синтетические и природные соединения. А. Вернер, один из основоположников координационной химии, приложил большие усилия к развитию неорганической стереохимии. Именно стереохимия является центральной в этой теории, до сих пор остающийся ориентиром в координационной химии.
Изомерия координационных соединений
Существуют изомеры двух типов:
1) соединения, в которых состав внутренней сферы и строение координированных лигандов идентичны (геометрические, оптические, конформационные, координационного положения);
2) соединения, для которых возможны различия в составе внутренней сферы и строении лигандов (ионизационные, гидратные, координационные, лигандные).
Пространственная (геометрическая) изомерия
2. Сначала заполняются орбитали, имеющие меньшую энергию .
С учетом этих правил при числе d-электронов в комплексообразователе от 1 до 3 или 8, 9, 10 их можно расположить по d-орбиталям только одним способом (в соответствии с правилом Хунда). При числе электронов от 4 до 7 в октаэдрическом комплексе возможно либо занятие орбиталей , уже заполненных одним электроном, либо заполнение свободных dγ -орбиталей более высокой энергии. В первом случае потребуется энергия на преодоление отталкивания между электронами, находящимися на одной и той же орбитали, во втором - для перехода на орбиталь более высокой энергии. Распределение электронов по орбиталям зависит от соотношения между величинами энергий расщепления (Δ) и спаривания электронов (Р). При низких значениях Δ («слабое поле»), величина Δ может быть < Р, тогда электроны займут разные орбитали, а спины их будут параллельны. При этом образуются внешнеорбитальные (высокоспиновые) комплексы, характеризующиеся определённым магнитным моментом µ. Если энергия межэлектронного отталкивания меньше, чем Δ («сильное поле»), то есть Δ > Р, происходит спаривание электронов на dε -орбиталях и образование внутриорбитальных (низкоспиновых) комплексов, магнитный момент которых µ =0.
Применение
Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам , хлорофилл находящийся в растениях является комплексом.
Комплексные соединения находят широкое применение в различных отраслях промышленности. Химические методы извлечения металлов из руд связаны с образованием КС. Например, для отделения золота от породы руду обрабатывают раствором цианида натрия в присутствии кислорода . Метод извлечения золота из руд с помощью растворов цианидов был предложен в 1843 г. русским инженером П. Багратионом. Для получения чистых железа , никеля , кобальта используют термическое разложение карбонилов металлов . Эти соединения - летучие жидкости, легко разлагающиеся с выделением соответствующих металлов .
Широкое применение комплексные соединения получили в аналитической химии в качестве индикаторов .
Многие КС обладают каталитической активностью, поэтому их широко используют в неорганическом и органическом синтезах. Таким образом, с использованием комплексных соединений связана возможность получения многообразных химических продуктов: лаков , красок , металлов , фотоматериалов , катализаторов , надёжных средств для переработки и консервирования пищи и т. д.
Комплесные соединения цианидов имеют важное значение в гальванопластике , так как из обычной соли бывает невозможно получить настолько прочное покрытие как при использовании комплексов.
Ссылки
Литература
- Ахметов Н. С. Общая и неорганическая химия. - М.: Высшая школа, 2003. - 743 с.
- Глинка Н. Л. Общая химия. - М.: Высшая школа, 2003. - 743 с.
- Киселев Ю. М. Химия координационных соединений. - М.: Интеграл-Пресс, 2008. - 728 с.
Среди биологически активных веществ, содержащихся в организме, ионы металлов занимают особое место. Так, биокатионы являются наиболее чувствительными "химическими точками" организма. Эти биогенные элементы жизни находятся в организме, главным образом, в виде водных растворов их солей и комплексных (координационных) соединений.
Комплексными соединениями называются соединения, в узлах кристаллической решетки которых находятся сложные частицы (комплексные ионы), состоящие из центрального атома или иона и окружающих его нейтральных молекул или ионов. Комплексные ионы не разрушаются при переходе их в раствор или расплав.
Строение комплексных соединений получило объяснение в координационной теории А. Вернера (1893г). По координационной теории Вернера комплексные соединения характеризуются особым пространственным расположением частиц, составляющих их молекулы. Например: K + | CN - CN - | K +
| CN - Fe 2+ CN - | K 4
K + | CN - CN - | K +
Из приведенной координационной формулы видно, что один из ионов занимает центральное положение. Такой атом или ион называется комплексообразователем . Чаще всего комплексообразователями являются положительно заряженные ионы металлов, чаще металлы побочных подгрупп (d- и f-элементов), значительно реже - нейтральные атомы металлов (Fe, Ni) и отрицательно заряженные атомы неметаллов (N -3 , O -2 , S). Типичными комплексообразователями являются такие металлы, как Fe, Cu, Ag, Au, Hg, Co, Cr, Mn, Cd, Ni, Pt, и др. d- и f-элементы. Вблизи комплексообразователя в определенном порядке расположены полярные молекулы или ионы другого знака, иногда те и другие, их называют лигандами (аддендами), что значит "связанные". Важнейшими лигандами являются:
a) Нейтральные молекулы, имеющие дипольный характер: H 2 O, NH 3 , CO, NO, C 2 H 4 .
б) Ионы: H - , O -2 , OH - , Cl - , J - , Br - , CN - , HCO 3 - , а также биолиганды в виде макромолекул аминокислот и их производных, пептидов, белков, ферментов, гормонов, нуклеиновых кислот и их фрагментов.
Комплексообразователь и лиганды образуют внутреннюю сферу (обозначается квадратными скобками), а ионы, не вошедшие во внутреннюю сферы, образуют внешнюю сферу. Внутреннюю сферу часто заключают в квадратные скобки. Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов. Число лигандов, располагающихся в непосредственной близости от центрального иона, называютсякоординационным числом иона (к.ч.). Часто встречаются координационные числа 2, 4, 6. Обычно координационное число в два раза больше заряда комплексообразователя, исключением является ион Fe 2+ , для которого к.ч. равно 6, для Pt 4+ - 6.
Если лиганды связаны с комплексообразователем одной связью и занимают одно координационное место во внутренней сфере комплекса, такие лиганды называются монодентантными (OH - , Cl - , J - , Br - , CN), две - бидентантными (CO 3 2- , С 2 О 4 2-) - они занимают 2 координационных места. Некоторые лиганды присоединяются к центральному иону и большим числом координационных связей. Так, среди сложных органических соединений есть такие, которые могут выступать в роли три, тетра - и более - их называют полидентантными. Полидентантные органические лиганды, замыкаясь двумя или несколькими координационными связями, могут образовывать циклические комплексы.
Молекулы комплексных соединений отличаются вполне определенной геометрической структурой. Так, два лиганда часто располагаются около иона металла таким образом, что центральный ион и 2 лиганда оказываются на одной прямой. Три лиганда размещаются по углам треугольника, четыре - по углам квадрата или четырехгранника (тетраэдра), шесть - по углам восьмигранника (октаэдра), восемь - по углам куба. Если лиганды неодинаковы, то геометрические формы могут быть и не совсем правильными (искаженными), но, тем не менее, лиганды остаются фиксированными в определенных точках пространства вокруг центрального иона.
Комплексные соединения классифицируют по заряду комплексного иона и по типу лигандов. По заряду комплексного иона комплексы бывают катионными (комплекс с положительным зарядом), анионными (комплекс с отрицательным зарядом), нейтральными (комплекс с нулевым зарядом).
По типу лигандов комплексы бывают: ацидокомплексы, - лигандами являются остатки кислот (Cl - , J - , Br - , CN - , HCO 3 - , CO 3 2- , С 2 О 4 2-); гидроксикомплексы (ОН -); аквакомплексы (H 2 O); аминокомплексы (NH 3); смешанные, когда в комплекс входят несколько типов лиганд.
Отсюда, для правильного написания формулы комплексного соединения нужно знать: заряд (степень окисления) комплексообразователя; заряд лигандов; координационное число комплексообразователя; ионы внешней сферы.
При написании формул комплексного иона первым указывается символ комплексообразователя, затем указываются нейтральные лиганды в порядке H 2 O, NH 3 . После нейтральных лигандов следуют анионные лиганды. Анионные лиганды перечисляются в порядке: Н - , О -2 , ОН - , простые анионы, сложные анионы неорганических кислот, анионы органических кислот.
Формулы комплексных соединений читают строго справа налево, соблюдая в формуле порядок расположения лигандов. В названиях комплексных соединений сначала называют анион в именительном падеже, а затем катион в родительном падеже.
I. Если в соединение входит комплексный катион , то сначала называют лиганды по порядку расположения в комплексе, после чего следует название комплексообразователя (русское название элемента). В скобках римскими цифрами показывают степень окисления комплексообразователя. Нейтральные молекулы, выступающие в качестве лигандов, имеют свое обычное название, кроме аммиака - амин, воды - аква, СО - карбонил, NO - нитрозил. Отрицательно заряженные лиганды называют с окончанием на «о». Например, Н - - гидридо, О -2 - оксо, ОН - - гидроксо, F - - фторо, Cl - - хлоро, S -2 - тио, CN - - циано, SO 4 -2 - сульфато, СН 3 СОО - - ацетато, CNS - - тиоцианато, С 2 О 4 -2 - оксалато. Если лигандов несколько, то вначале называют ион внешней сферы, затем лиганды греческими числами: - 2-ди, 3-три и т.д.
Например: названия комплексных катионов
[Со Н 2 О (NH 3) 5 ] Cl 3 - хлорид пентаамминаквакобальта (III)
Cl 3 - хлорид хлоропентаамминплатины (IV)
NO 3 - нитрат гидроксодиамминакваплатины (II)
SO 4 - сульфат тетрааквамеди (II)
II. Если в соединение входит комплексный анион , то сначала называют лиганды по указанному выше порядку. Далее называют комплексообразователь, используя корень его латинского названия с добавлением слога – «ат», после чего в скобках римскими цифрами указывают степень окисления комплексообразователя. В последнюю очередь называется катион внешней сферы в родительном падеже. Например:
K - дицианоаргентат (I) калия
K 2 - тетрахлорокупрат (II) калия
K 3 - гексацианоферрат (III) калия
K 2 - динитродихлороплатинат (IV) калия
Наименование нейтральных комплексов составляются из названия лигандов и русского названия комплексообразователя в именительном падеже. При этом валентность комплексообразователя не указывается. Например: - трихлоротриамминкобальт.
Тетрахлородиамминплатина.
Внутренняя и внешняя сфера в молекулах комплексных соединений связана ионной связью. Комплексообразователь и лиганды связаны ковалентной связью по донорно-акцепторному механизму: лиганды играют роль донора электронной пары, а комплексообразователь - роль акцептора , на свободной орбитали которого располагается электронная пара лиганда.
Диссоциация комплексных соединений идет в две ступени. Первичная диссоциация комплексных соединений идет по типу ионизации сильных электролитов и протекает нацело: Cl → + + Cl -
Лиганды с комплексообразователем связаны более прочной связью и диссоциация комплексного иона протекает в меньшей степени. Этот вид диссоциации называется вторичной .
+ → Ag + + 2NH 3
Мерой устойчивости комплексного иона служит его константа нестойкости и обозначается К н.
Чем меньше константа нестойкости, тем устойчивее комплекс.
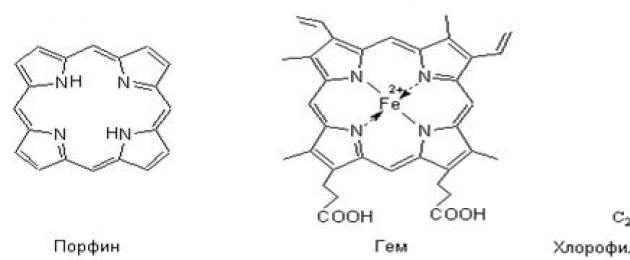
Комплексные соединения играют огромную роль в процессах жизнедеятельности растений и животных. В организме животных и растений комплексные соединения выполняют самые разнообразные функции: накопление и перемещение различных веществ и энергии; образование и расщепление химических связей; участие в процессах дыхания, фотосинтеза, биологического окисления и ферментативном катализе. Такие важнейшие в биологическом отношении вещества, как гемоглобин, хлорофилл, цианкоболамин, являются внутрикомплексными, хелатными соединениями. В них четыре координационных места занимает одна частица, называемая порфином, а комплексообразователем в гемоглобине является - Fe +2 , а в хлорофилле - Mg 2 , в витамине B 12 - Cо +3 .

Комплекс железа с порфирином имеет плоское строение, в котором ион железа соединен 4 координационными связями с 4 пиррольными кольцами, 5 связь идет на присоединение белка глобина, но шестое место в координационной сфере свободно. Это место и занимает молекула кислорода, переносимого гемоглобином в процессе дыхания.
В последнее время установлено, что комплексные соединения платины и палладия оказывают тормозящее действие на развитие злокачественных опухолей и с успехом могут применяться для терапевтических целей, образование хелатных (внутрикомплексных) соединений, используются при растворении солей в почечных камнях и снижении жесткости воды, обусловленной присутствием ионов кальция и магния. Известна высокая бактерицидная активность некоторых комплексных соединений серебра. Трилон Б (ЭДТА) способен образовывать комплексы со многими металлами, в том числе с Са +2 . Это дает возможность применять его при заболеваниях, сопровождающихся избыточным отложением солей кальция в организме.
Биогенные элементы
Изучение распространенности отдельных элементов и их изотопов позволяет отметить следующие закономерности.
1. Элементы с чётными порядковыми номерами характеризуются повышенной распространенностью. На Земле содержание чётных элементов составляет 97,21 % от массы всех элементов.
2. Наиболее распространены элементы, изотопы которых имеют массовое число, кратное 4. Примерами таких элементов могут служить He, O, Ne, Si, S, Ar, Fe, Ni и др.
На Земле непрерывно происходят ядерные процессы, ведущие, в конечном счёте, к изменению их изотопного состава. Однако, все эти процессы идут медленно. Результаты анализа вещества земной коры показывают, что изотопный состав элементов на Земле практически постоянен. Первые исследования о взаимосвязи земной коры и химического состава живых организмов сделаны русским учёным В.И Вернадским. Он, считал, что земная кора и живые организмы составляют единую систему. Единство живого и неживого заключается, прежде всего, в общности их элементарного состава. Вещества живой и неживой природы состоят из одних и тех же химических элементов, связанных ковалентной, ионной, водородной связями.
В результате длительного непрерывного воздействия на организм определённого по химическому составу потока атомов происходит подбор и распределение организмов по разным зонам Земли, а наряду с этим наступает и изменчивость организмов. Так, например, недостаточность йода в гористых местностях и по долинам рек, вызывает увеличение щитовидной железы и зоб у животных и человека. С ростом цивилизации в организм человека поступает всё больше биологически активных ненужных веществ, таких как: ртуть (из зубных пломб), свинец, сурьма, мышьяк (из газет), ионы металлов (из кухонной посуды).
Исследования учёных США указали на недостаток хрома в тканях организма жителей, в сравнении с обитателями Африки и Азии. Это вызвано излишком рафинированного сахара и других очищенных продуктов в рационе человека. Недостаток хрома объясняет рост числа сердечных заболеваний.
Элементы, играющие важную роль в физиологических и патологических процессах, в организме человека называются
менее 10 -5
| Li, Be, Pb, Mo, W, Cd, Ni, Ag | Se |
В зависимости от строения (электронной конфигурации) атома, биогенные элементы подразделяются на s, p, d -биоэлементы.
s-элементы ns 2: H, Na, Mg, Ca, Sr, Ba (6)
p-элементы ns 2 np 1-6: Al, C, Si, Sn, Pb, N, P, O, S, Se, F, Cl, I, Br, B (15)
d-элементы (n-1)d 1-10 ns 2: Cu, Zn, Cr , Mn, Fe, Co, Ni (7)
Глава 17.Комплексные соединения
17.1. Основные определения
В этой главе вы познакомитесь с особой группой сложных веществ, называемых комплексными (или координационными ) соединениями .
В настоящее время строгого определения понятия " комплексная частица" нет. Обычно используется следующее определение.
Например, гидратированный ион меди 2 – комплексная частица, так как она реально существует в растворах и некоторых кристаллогидратах, образована из ионов Cu 2 и молекул H 2 O, молекулы воды – реально существующие молекулы, а ионы Cu 2 существуют в кристаллах многих соединений меди. Напротив, ион SO 4 2 не является комплексной частицей, так как, хоть ионы O 2 в кристаллах встречаются, ион S 6 в химических системах не существует.
Примеры других комплексных частиц: 2 , 3 , , 2 .
Вместе с тем к комплексным частицам относят ионы NH 4 и H 3 O , хотя ионы H в химических системах не существуют.
Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму. В большинстве комплексных частиц так и есть, но, например, в алюмокалиевых квасцах SO 4 в комплексной частице 3 связь между атомами Al и O действительно образована по донорно-акцепторному механизму, а в комплексной частице имеется лишь электростатическое (ион-дипольное) взаимодействие. Подтверждение этого – существование в железоаммонийных квасцах аналогичной по строению комплексной частицы , в которой между молекулами воды и ионом NH 4 возможно только ион-дипольное взаимодействие.
По заряду комплексные частицы могут быть катионами, анионами, а также нейтральными молекулами. Комплексные соединения, включающие такие частицы, могут относиться к различным классам химических веществ (кислотам, основаниям, солям). Примеры: (H 3 O) – кислота, OH – основание, NH 4 Cl и K 3 – соли.
Обычно комплексообразователь – атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; при образовании комплексного соединения из более простых веществ она не меняется.
Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H 2 O, CO, NH 3 и др.), анионы (OH , Cl , PO 4 3 и др.), а также катион водорода. Различают унидентатные или монодентатные лиганды (связанные с центральным атомом через один из своих атомов, то есть, одной -связью), бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя -связями), тридентатные и т. д.
Если лиганды унидентатные, то координационное число равно числу таких лигандов.
КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Существуют комплексные частицы и с несколькими центральными атомами.
Используются два вида структурных формул комплексных частиц: с указанием формального заряда центрального атома и лигандов, или с указанием формального заряда всей комплексной частицы. Примеры:

Для характеристики формы комплексной частицы используется представление о координационном полиэдре (многограннике).

К координационным полиэдрам относят также квадрат (КЧ = 4), треугольник (КЧ = 3) и гантель (КЧ = 2), хотя эти фигуры и не являются многогранниками. Примеры координационных полиэдров и имеющих соответствующую форму комплексных частиц для наиболее распространенных значений КЧ приведены на рис. 1.
17.2. Классификация комплексных соединений
Как химические вещества комплексные соединения делятся на ионные (их иногда называют ионогенными ) и молекулярные (неионогенные ) соединения. Ионные комплексные соединения содержат заряженные комплексные частицы – ионы – и являются кислотами, основаниями или солями (см. § 1). Молекулярные комплексные соединения состоят из незаряженных комплексных частиц (молекул), например: или – отнесение их к какому-либо основному классу химических веществ затруднительно.
Входящие в состав комплексных соединений комплексные частицы довольно разнообразны. Поэтому для их классификации используется несколько классификационных признаков: число центральных атомов, тип лиганда, координационное число и другие.
По числу центральных атомов комплексные частицы делятся на одноядерные и многоядерные . Центральные атомы многоядерных комплексных частиц могут быть связаны между собой либо непосредственно, либо через лиганды. И в том, и в другом случае центральные атомы с лигандами образуют единую внутреннюю сферу комплексного соединения:


По типу лигандов комплексные частицы делятся на
1) Аквакомплексы , то есть комплексные частицы, в которых в качестве лигандов присутствуют молекулы воды. Более или менее устойчивы катионные аквакомплексы m , анионные аквакомплексы неустойчивы. Все кристаллогидраты относятся к соединениям, содержащим аквакомплексы, например:
Mg(ClO 4) 2 . 6H 2 O на самом деле
(ClO 4) 2 ;
BeSO 4 . 4H 2 O на самом деле SO 4 ;
Zn(BrO 3) 2 . 6H 2 O на самом деле (BrO 3) 2 ;
CuSO 4 . 5H 2 O на самом деле SO 4 . H 2 O.
2) Гидроксокомплексы , то есть комплексные частицы, в которых в качестве лигандов присутствуют гидроксильные группы, которые до вхождения в состав комплексной частицы были гидроксид-ионами, например: 2 , 3 , .
Гидроксокомплексы образуются из аквакомплексов, проявляющих свойства катионных кислот:
2 + 4OH = 2 + 4H 2 O
3) Аммиакаты , то есть комплексные частицы, в которых в качестве лигандов присутствуют группы NH 3 (до образования комплексной частицы – молекулы аммиака), например: 2 , , 3 .
Аммиакаты также могут быть получены из аквакомплексов, например:
2 + 4NH 3 = 2 + 4 H 2 O
Окраска раствора в этом случае меняется с голубой до ультрамариновой.
4) Ацидокомплексы , то есть комплексные частицы, в которых в качестве лигандов присутствуют кислотные остатки как бескислородных, так и кислородсодержащих кислот (до образования комплексной частицы – анионы, например: Cl , Br , I , CN , S 2 , NO 2 , S 2 O 3 2 , CO 3 2 , C 2 O 4 2 и т. п.).
Примеры образования ацидокомплексов:
Hg 2
+ 4I = 2
AgBr + 2S 2 O 3 2 = 3 + Br
Последняя реакция используется в фотографии
для удаления с фотоматериалов
непрореагировавшего бромида серебра.
(При проявлении фотопленки и фотобумаги
незасвеченная часть бромида серебра,
содержащегося в фотографической эмульсии, не
восстанавливается проявителем. Для ее удаления
и используют эту реакцию (процесс носит
название "фиксирования", так как
неудаленный бромид серебра в дальнейшем на свету
постепенно разлагается, разрушая изображение)
5) Комплексы, в которых лигандами являются атомы водорода, делятся на две совершенно разные группы: гидридные комплексы и комплексы, входящие в состав ониевых соединений.
При образовании гидридных комплексов – , , – центральный атом является акцептором электронов, а донором – гидридный ион. Степень окисления атомов водорода в этих комплексах равна –1.
В ониевых комплексах центральный атом является донором электронов, а акцептором – атом водорода в степени окисления +1. Примеры: H 3 O или – ион оксония, NH 4 или – ион аммония. Кроме того существуют и замещенные производные таких ионов: – ион тетраметиламмония, – ион тетрафениларсония, – ион диэтилоксония и т. п.
6) Карбонильные комплексы – комплексы, в которых в качестве лигандов присутствуют группы CO (до образования комплекса – молекулы монооксида углерода), например: , , и др.
7) Анионгалогенатные комплексы – комплексы типа .
По типу лигандов выделяют и другие классы комплексных частиц. Кроме того существуют комплексные частицы с различными по типу лигандами; простейший пример – аква-гидроксокомплекс .
17.3. Основы номенклатуры комплексных соединений
Формула комплексного соединения составляется также, как и формула любого ионного вещества: на первом месте записывается формула катиона, на втором – аниона.
Формула комплексной частицы записывается в квадратных скобках в следующей последовательности: на первом месте ставится символ элемента-комплексообразователя, далее – формулы лигандов, бывших до образования комплекса катионами, затем – формулы лигандов, бывших до образования комплекса нейтральными молекулами, и после них – формулы лигандов, бывших до образования комплекса анионами.
Название комплексного соединения строится также, как и название любой соли или основания (комплексные кислоты называются солями водорода или оксония). В название соединения входит название катиона и название аниона.
В название комплексной частицы входит название комплексообразователя и названия лигандов (название записывается в соответствии с формулой, но справа налево. Для комплексообразователей в катионах используются русские названия элементов, а в анионах – латинские.
Названия наиболее распространенных лигандов:
| H 2 O – аква | Cl – хлоро | SO 4 2 – сульфато | OH – гидроксо |
| CO – карбонил | Br – бромо | CO 3 2 – карбонато | H – гидридо |
| NH 3 – аммин | NO 2 – нитро | CN – циано | NO – нитрозо |
| NO – нитрозил | O 2 – оксо | NCS – тиоцианато | H +I – гидро |
Примеры названий комплексных катионов:
Примеры названий комплексных анионов:
2
– тетрагидроксоцинкат-ион
3 – ди(тиосульфато)аргентат(I)-ион
3
– гексацианохромат(III)-ион
–
тетрагидроксодиакваалюминат-ион
–
тетранитродиамминкобальтат(III)-ион
3 – пентацианоакваферрат(II)-ион
Примеры названий нейтральных комплексных частиц:
Более подробные номенклатурные правила приводятся в справочниках и специальных пособиях.
17.4. Химическая связь в комплексных соединениях и их строение
В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная.
В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму (как следствие – с изменением формальных зарядов). В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью.
Рассмотрим ее образование на примере аквакатиона железа(II). Этот ион образуется по реакции:
FeCl 2кр + 6H 2 O = 2 + 2Cl
Электронная формула атома железа – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 . Составим схему валентных подуровней этого атома:
При образовании двухзарядного иона атом железа теряет два 4s -электрона:
Ион железа акцептирует шесть электронных пар атомов кислорода шести молекул воды на свободные валентные орбитали:

Образуется комплексный катион, химическое строение которого можно выразить одной из следующих формул:

Пространственное строение этой частицы выражается одной из пространственных формул:

Форма координационного полиэдра – октаэдр. Все связи Fe-O одинаковые. Предполагается sp 3 d 2 -гибридизация АО атома железа. Магнитные свойства комплекса указывают на наличие неспаренных электронов.
Если FeCl 2 растворять в растворе, содержащем цианид-ионы, то протекает реакция
FeCl 2кр + 6CN = 4 + 2Cl .
Тот же комплекс получается и при добавлении к раствору FeCl 2 раствора цианида калия KCN:
2 + 6CN = 4 + 6H 2 O .
Это говорит о том, что цианидный комплекс прочнее аквакомплекса. Кроме того магнитные свойства цианидного комплекса указывают на отсутствие неспаренных электронов у атома железа. Все это связано с несколько иным электронным строением этого комплекса:

Более " сильные" лиганды CN образуют более прочные связи с атомом железа, выигрыша в энергии хватает на то, чтобы " нарушить" правило Хунда и освободить 3d -орбитали для неподеленных пар лигандов. Пространственное строение цианидного комплекса такое же, как и аквакомплекса, но тип гибридизации другой – d 2 sp 3 .
" Сила" лиганда зависит прежде всего от электронной плотности облака неподеленной пары электронов, то есть, она увеличивается с уменьшением размера атома, с уменьшением главного квантового числа, зависит от типа гибридизации ЭО и от некоторых других факторов. Важнейшие лиганды можно выстроить в ряд по возрастанию их " силы" (своеобразный " ряд активности" лигандов), этот ряд называется спектрохимическим рядом лигандов :
| I ; Br ; : SCN , Cl , F , OH , H 2 O; : NCS , NH 3 ; SO 3 S: 2 ; : CN , CO |
Для комплексов 3 и 3 схемы образования выглядят следующим образом:
|
|
Для комплексов с КЧ = 4 возможны две структуры: тетраэдр (в случае sp 3 -гибридизации), например, 2 , и плоский квадрат (в случае dsp 2 -гибридизации), например, 2 .
17.5. Химические свойства комплексных соединений
Для комплексных соединений прежде всего характерны те же свойства, что и для обычных соединений тех же классов (соли, кислоты, основания).
Если комплексное соединение кислота, то это сильная кислота, если основание, то и основание сильное. Эти свойства комплексных соединений определяются только наличием ионов H 3 O или OH . Кроме этого комплексные кислоты, основания и соли вступают в обычные реакции обмена, например:
SO 4 + BaCl 2 = BaSO 4 + Cl 2
FeCl 3 + K 4 = Fe 4 3
+ 3KCl
Последняя из этих реакций используется в качестве качественной реакции на ионы Fe 3 . Образующееся нерастворимое вещество ультрамаринового цвета называют " берлинской лазурью" [систематическое название – гексацианоферрат(II) железа(III)-калия].
Кроме этого в реакцию может вступать и сама комплексная частица, причем, тем активнее, чем она менее устойчива. Обычно это реакции замещения лигандов, протекающие в растворе, например:
2 + 4NH 3 = 2 + 4H 2 O,
а также кислотно-основные реакции типа
2 + 2H 3 O = + 2H 2 O
2 + 2OH
= + 2H 2 O
Образующийся в этих реакциях после выделения и высушивания превращается в гидроксид цинка:
Zn(OH) 2 + 2H 2 O
Последняя реакция – простейший пример разложения комплексного соединения. В данном случае она протекает при комнатной температуре. Другие комплексные соединения разлагаются при нагревании, например:
SO 4 . H 2 O = CuSO 4
+ 4NH 3 + H 2 O (выше 300 o С)
4K 3 = 12KNO 2 + 4CoO + 4NO + 8NO 2
(выше 200 o С)
K 2 = K 2 ZnO 2 + 2H 2 O
(выше 100 o С)
Для оценки возможности протекания реакции замещения лигандов можно использовать спектрохимический ряд, руководствуясь тем, что более сильные лиганды вытесняют из внутренней сферы менее сильные.
17.6. Изомерия комплексных соединений
Изомерия комплексных соединений связана
1) с возможным различным расположением лигандов и
внешнесферных частиц,
2) с различным строением самой комплексной
частицы.
К первой группе относится гидратная (в общем случае сольватная ) и ионизационная изомерия, ко второй – пространственная и оптическая .
Гидратная изомерия связана с возможностью различного распределения молекул воды во внешней и внутренней сферах комплексного соединения, например: (цвет красно-коричневый) и Br 2 (цвет голубой).
Ионизационная изомерия связана с возможностью различного распределения ионов во внешней и внутренней сфере, например: SO 4 (пурпурного цвета) и Br (красного цвета). Первое из этих соединений образует осадок, реагируя с раствором хлорида бария, а второе – с раствором нитрата серебра.
Пространственная (геометрическая) изомерия, иначе называемая цис-транс изомерией, характерна для квадратных и октаэдрических комплексов (для тетраэдрических невозможна). Пример: цис-транс изомерия квадратного комплекса

Оптическая (зеркальная) изомерия по своей сути не отличается от оптической изомерии в органической химии и характерна для тетраэдрических и октаэдрических комплексов (для квадратных невозможна).
Комплексные соединения
Конспект урока-лекции
Цели.
Сформировать представления о
составе, строении, свойствах и номенклатуре
комплексных соединений; развить навыки
определения степени окисления у
комплексообразователя, составления уравнений
диссоциации комплексных соединений.
Новые понятия:
комплексное соединение,
комплексообразователь, лиганд, координационное
число, внешняя и внутренняя сферы комплекса.
Оборудование и реактивы.
Штатив с
пробирками, концентрированный раствор аммиака,
растворы сульфата меди(II), нитрата серебра,
гидроксида натрия.
ХОД УРОКА
Лабораторный опыт. К раствору сульфата меди(II) прилить раствор аммиака. Жидкость окрасится в интенсивный синий цвет.
Что произошло? Химическая реакция? До сих пор мы не знали, что аммиак может реагировать с солью. Какое вещество образовалось? Каковы его формула, строение, название? К какому классу соединений его можно отнести? Может ли аммиак реагировать с другими солями? Есть ли соединения, аналогичные этому? Ответить на эти вопросы нам и предстоит сегодня.
Чтобы лучше изучить свойства некоторых соединений железа, меди, серебра, алюминия, нам потребуются знания о комплексных соединениях.
Продолжим наш опыт. Полученный раствор разделим на две части. К одной части прильем щелочь. Осадка гидроксида меди(II) Cu(OH) 2 не наблюдается, следовательно, в растворе нет двухзарядных ионов меди или их слишком мало. Отсюда можно заключить, что ионы меди вступают во взаимодействие с прибавленным аммиаком и образуют какие-то новые ионы, которые не дают нерастворимого соединения с ионами OH – .
В то же время ионы остаются неизменными. В этом можно убедиться, прибавив к аммиачному раствору раствор хлорида бария. Тотчас же выпадет белый осадок BaSO 4 .
Исследованиями установлено, что темно-синяя окраска аммиачного раствора обусловлена присутствием в нем сложных ионов 2+ , образовавшихся путем присоединения к иону меди четырех молекул аммиака. При испарении воды ионы 2+ связываются с ионами , и из раствора выделяются темно-синие кристаллы, состав которых выражается формулой SO 4 H 2 O.
Комплексными называют соединения, содержащие сложные ионы и молекулы, способные к существованию как в кристаллическом виде, так и в растворах.
Формулы молекул или ионов комплексных соединений обычно заключают в квадратные скобки. Комплексные соединения получают из обычных (некомплексных) соединений.
Примеры получения комплексных соединений
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
 |
А.Вернер
|
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь , внешнюю и внутреннюю сферы . Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определенное число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами . Число лигандов определяет координационное число (КЧ) комплексообразователя.
Пример комплексного соединения

Рассмотренное в примере соединение SO 4 H 2 O или CuSO 4 5Н 2 О – это кристаллогидрат сульфата меди(II).
Определим составные части других комплексных
соединений, например K 4 .
(Справка.
Вещество с формулой HCN – это
синильная кислота. Соли синильной кислоты
называют цианидами.)
Комплексообразователь – ион железа Fe 2+ , лиганды – цианид-ионы СN – , координационное число равно шести. Все, что записано в квадратных скобках, – внутренняя сфера. Ионы калия образуют внешнюю сферу комплексного соединения.
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой – между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счет неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы. Например:
SO 4 2+ + .
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава:
SO 4 + BaCl 2 = Cl 2 + BaSO 4 .
Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы.
Таким нейтральным комплексом является, например, .
Наиболее типичными комплексообразователями являются катионы d -элементов.
Лигандами могут быть:
а) полярные молекулы – NH 3 , Н 2 О, CO, NO;
б) простые ионы – F – , Cl – , Br – , I – ,
H – , H + ;
в) сложные ионы – CN – , SCN – , NO 2 – ,
OH – .
Pассмотрим таблицу, в которой приведены координационные числа некоторых комплексообразователей.
Номенклатура комплексных соединений. В соединении сначала называют анион, а затем катион. При указании состава внутренней сферы прежде всего называют анионы, прибавляя к латинскому названию суффикс -о- , например: Cl – – хлоро, CN – – циано, OH – – гидроксо и т.д. Далее называют нейтральные лиганды и в первую очередь аммиак и его производные. При этом пользуются терминами: для координированного аммиака – аммин , для воды – аква . Число лигандов указывают греческими словами: 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем переходят к названию центрального атома. Если центральный атом входит в состав катионов, то используют русское название соответствующего элемента и в скобках указывают его степень окисления (римскими цифрами). Если центральный атом содержится в анионе, то употребляют латинское название элемента, а в конце прибавляют окончание -ат . В случае неэлектролитов степень окисления центрального атома не приводят, т.к. она однозначно определяется из условия электронейтральности комплекса.
Примеры.
Чтобы назвать комплекс Сl 2 ,
определяют степень окисления
(С.О.)
х
комплексообразователя – иона Cu х
+ :
1 x + 2 (–1) = 0, x = +2, C.O.(Cu) = +2.
Аналогично находят степень окисления иона кобальта:
![]()
y + 2 (–1) + (–1) = 0, y = +3, С.О.(Со) = +3.
Чему равно координационное число кобальта в этом соединении? Сколько молекул и ионов окружает центральный ион? Координационное число кобальта равно шести.
Название комплексного иона пишут в одно слово. Степень окисления центрального атома обозначают римской цифрой, помещенной в круглые скобки. Например:
Cl 2 – хлорид
тетраамминмеди(II),
NO 3 –
нитрат
дихлороакватриамминкобальта(III),
K 3 – гексацианоферрат(III)
калия,
K 2 – тетрахлороплатинат(II)
калия,
–
дихлоротетраамминцинк,
H 2 – гексахлорооловянная кислота.
На примере нескольких комплексных соединений определим структуру молекул (ион-комплексообразователь, его С.О., координационное число, лиганды, внутреннюю и внешнюю сферы), дадим название комплексу, запишем уравнения электролитической диссоциации.

K 4 – гексацианоферрат(II) калия,
K 4 4K + + 4– .

H – тетрахлорозолотая кислота (образуется при растворении золота в «царской водке»),
H H + + –.

OH – гидроксид диамминсеребра(I) (это вещество участвует в реакции «серебряного зеркала»),
OH + + OH – .

Na – тетрагидроксоалюминат натрия,
Na Na + + – .
К комплексным соединениям относятся и многие органические вещества, в частности, известные вам продукты взаимодействия аминов с водой и кислотами. Например, соли хлорид метиламмония и хлорид фениламмония являются комплексными соединениями. Согласно координационной теории они имеют следующее строение:

Здесь атом азота – комплексообразователь, атомы водорода при азоте, радикалы метил и фенил – лиганды. Вместе они образуют внутреннюю сферу. Во внешней сфере находятся хлорид-ионы.
Многие органические вещества, имеющие большое значение в жизнедеятельности организмов, представляют собой комплексные соединения. К ним относятся гемоглобин, хлорофилл, ферменты и др.
Комплексные соединения находят широкое применение:
1) в аналитической химии для определения многих ионов;
2) для разделения некоторых металлов и получения металлов высокой степени чистоты;
3) в качестве красителей;
4) для устранения жесткости воды;
5) в качестве катализаторов важных биохимических процессов.
Класс: 11
Ключевые слова: соединения , комплексные ионы
Модульный урок
Структура модуля
УЭ-0. Интегрирующие дидактические цели.
УЭ-1. Повторение. Химическая связь, схема ее образования.
УЭ-2. Координационная теория Альфреда Вернера.
УЭ-3. Классификация комплексных соединений.
УЭ-4. Получение комплексных соединений.
УЭ-5. Применение, значение комплексов.
УЭ-6. Свойства комплексных соединений.
УЭ-7. Резюме.
УЭ-8. Контроль.
Оборудование к уроку. На демонстрационном столе:
- концентрированные растворы соляной кислоты и аммиака;
- растворы сульфата алюминия и гидроксида натрия, сульфата меди (П), хлорида железа (III), роданида калия; кристаллический калий железосинеродистый (красная кровяная соль);
- демонстрационные пробирки или цилиндры, экран с подсветкой;
- магнитная доска с набором аппликаций;
- плакат с изображением структурных формул молекул хлорофилла и гемоглобина;
- таблица "Состав комплексных соединений";
- вытяжка хлорофилла в этаноле.
УЭ-0. Интегрирующие дидактические цели
- Повторить механизм образования ковалентной связи.
- Познакомиться с новым классом соединений, классификацией.
- Изучить содержание теории комплексных соединений.
- Используя химический эксперимент, добиться усвоения получения, физических и химических свойств комплексных соединений.
- Комплексные соединения в окислительно-восстановительных реакциях.
- Познакомиться с применением веществ данного класса.
УЭ-1. Механизм образования ковалентной связи
Частные дидактические цели:
- Повторить механизм образования ковалентной связи.
- Образование ковалентной связи в молекулах воды, гидроксония, иона аммония.
Руководство. Запишите схему образования молекул: воды, иона гидроксония и аммония. Объясните механизм образования иона аммония.
Донорно-акцепторная связь в ионе аммония. Что является донором, а что является акцептором?
УЭ-2. Координационная теория Альфреда Вернера
Частные дидактические цели:
- Мотивация, постановка проблемы.
- Знакомство с новым классом соединений.
- Изучение строения комплексных соединений (комплексообразователь, лиганды, внутренняя сфера, внешняя сфера).
- Диссоциация комплексов на внешнюю и внутреннюю сферу.
- Уметь определять координационное число комплексообразователя.
- Определять вид химической связи между комплексообразователем и лигандами, внешней и внутренней сферой.
- Уметь называть комплексные соединения.
1. Руководство
В 1597 году немецкий алхимик и врач Либавий проводил опыты с медным купоросом в поисках лекарства для лечения ран, кожных болезней. Повторите старинный опыт, которому в 2007 году исполнилось 410 лет.
Налейте в химический стакан на 1/4 объема раствор сульфата меди(II) и небольшими порциями добавьте раствор аммиака.
Запишите уравнение химической реакции. Ваши наблюдения?
CuSO4 + NH3*H2O= ? + ?
Совпадают ли Ваши наблюдения с предполагаемым продуктом реакции? Объясните Ваши наблюдения, укажите цвет и агрегатное состояние полученного вещества.
Что кроется за калейдоскопом цветов?
Либавий не нашел объяснения случившемуся, бессильны оказались и все его современники. Так Либавий получил первое комплексное соединение, природу которого химики выяснили только в конце ХIХ века. Классическое учение о валентности, разработанное А. Кекуле, Э. Франклендом не могло объяснить, за счет чего объединяются валентно насыщенные молекулы.
Сможете ли вы объяснить проведенные опыты?
2. Ознакомьтесь с теоретическим материалом, запишите основные понятия в тетрадь, ответьте на вопросы самоконтроля
Опорный конспект
В конце XIX века швейцарский химик А.Вернер в 1893 году разработал координационную теорию, в основе которой положения теории пространственного строения веществ и теория электролитической диссоциации.
Были ведены следующие понятия:1) комплексные соединения; 2) атом-комплексообразователь (или центральный атом); 3) лиганды (атомы, ионы, полярные молекулы или неполярные молекулы, связанные с центральным атомом);
4) координационное число центрального атома (число лигандов).
Комплексный ион - это ион, состоящий из комплексообразователя и лигандов(внутренняя сфера).
Комплексообразователь (центральный атом или ион) - это атом (или ион), к которому присоединено определённое число молекул или ионов.
Лиганд - молекула или ион, входящий в состав комплексного иона, связанный с центральным атомом (ионом) донорно-акцепторной связью. "Лиганд" переводится как "связанный".
Вакансия - свободная электронная ячейка d-металла, которая может быть использована для образования донорно-акцепторной связи с лигандами.
Комплексное соединение - сложное вещество, в состав которого входит комплексный ион.
1. Соединения, имеющие в своём составе комплексные ионы, относятся к комплексным соединениям.
Координационное число (К.Ч.) - число, указывающее количество лигандов, которое способен присоединить к себе комплексообразователь. Может иметь значения 2, 4, 6, 8, 10 и другие.
Суммарный заряд образовавшегося комплексного иона равен алгебраической сумме зарядов центрального атома (иона) и лигандов.

Названия комплексных соединений: Na - тетрагидроксоалюминат натрия,
SO 4 - сульфат тетраамминмеди (II).
Вывод. Связи между комплексообразователем и лигандами осуществляются с помощью электронных пар. Оба электрона каждой связи предоставляются одним атомом, то есть связи образуются по донорно-акцепторному механизму. Донор электронов - лиганды (молекулы аммиака), а акцептор - центральный атом (ион - комплексообразователь Zn 2+) .
Пространственное строение комплексных соединений.
Ионы-комплексообразователи (акцепторы) предоставляют свои свободные орбитали, а лиганды (доноры) оба электрона. Пространственное строение комплексного иона определяется типом гибридизации орбиталей.


- , +
линейная молекула -- sp-гибридизация, тетраэдр sp-гибридизация.
Проверьте свои знания
Самоконтроль (УЭ-2)
I уровень
K 2 , Na 4 , (N0 3) 2 . (1балл)
Пример ответа: K 2 = 2К + + 2- .
2. Составить формулу комплексного соединения, если известно, что его молекула содержит ионы Ni 2+ , 3C1 , а также три молекулы NH 3 . (2балл а)
3. Определить внутреннюю и внешнюю сферы комплексного соединения, координационное число (к. ч.) металла, заряд центрального иона металла, заряд комплексного иона для соединений:
H 4 , S0 4 , K 4 , Cl 3 . (2балла)
Пример ответа: H 4 + , к. ч. = 6. внешняя, внутренняя сфера
II уровень
1. Написать уравнения диссоциации веществ:
K 4 ,
Na 2 ;
Cl 2 ;
[А1(Н 2 О) 6 ] С1 3 (1балл)
2. Напишите формулу комплексного иона, в котором комплексообразователь - ион Fe 3 + с к. ч. равным 6, а лиганды - ионы F. Каков заряд комплексного иона? (2балла)
3. Определите координационное число центрального атома в комплексах, внутреннюю и внешнюю сферу, заряд комплексного иона: C1; K 4 ; [Со(NН 3) 3 ]С1 3 . Запишите диссоциацию данных веществ. (2 балла )
Если вы набрали 4-5 баллов, приступайте к изучению следующего учебного элемента.
Если же вы набрали меньше 4 баллов, то вернитесь и прочитайте еще раз УЧЕБНЫЙ ЭЛЕМЕНТ-1 (УЭ-1), поработайте с опорным конспектом.
Ознакомьтесь с теоретическим материалом УЭ-3, проверьте свои знания самоконтролем.
УЭ-3. Классификация комплексных соединений
Частные дидактические цели:
1. Познакомиться с классификацией комплексных соединений по составу внутренней и внешней сферы;
В зависимости от природы лиганда различают:
1) аквакомплексы (Н 2 О): [Сг(Н 2 О) 6 ]С1 3 ;
2) аммиакаты (NH 3): SO 4 , Cl;
3) гидроксокомплексы (ОН~): K 2 , Na2;
4) ацидокомплексы (кислотные остатки): K 4 , K 2 ;
5) комплексы смешанного типа: Cl, C1 4 , C1О 4 .
Центральным атомом могут быть как ионы металла так и ионы неметалла.
Центральный атом - неметалл: К - тетрафтороборат(III) калия.
Центральный атом - металл: Na -тетрагидроксоалюминат натрия.
Состав комплексных соединений
| Состав | |||||
| Внутренняя сфера | (комплексный ион) | внешняя сфера | К.ч. центрального атома (иона) | ||
| комплексные соединения | названия комплексных соединений | центральный атом | лиганды | ||
| NH 4 C1 | Хлорид аммония | Н + | NH 3 | Cl | 1 |
| Na | Тетрагидроксоалюминат натрия | А1 3+ | 4ОН | Na+ | 4 |
| S0 4 | Сульфат тетраамминмеди (II) | Си 2+ | 4NH 3 | S0 | 4 |
| K 3 | Гексацианоферрат (III) калия | Fe | 6CN | ЗК + | 6 |
| Fe 3 2 | Гексацианоферрат (III) железа (II) | Fe | 6CN | 3Fe 2 + | 6 |
Проверьте свои знания
Самоконтроль (УЭ-3)
I уровень
1.Из предложенных ниже ответов выберите тот, который характеризует ион-комплексообразователь и его заряд в соединении Na 4 :
a) Fe 3+ ; б) CN; в) Fe 2 + ; г) Na + ; д) Na.
2. Какая из приведенных ниже формул соответствует гексагидроксоалюминату натрия:
а) [А1(Н 2 О) 6 ] С1 3 ; б) Na; в) Na [А1(ОН) 4 (Н 2 0) 2 ]; г) NaAlO 2 ; д) Na 3 ?
3.Какие ионы образует при электролитической диссоциации в воде хлорид тетраамминмеди (II) : C1 2: a) Си 2+ , Сl; б) 2+ , Сl; в) Cu 2+ , NH 3 , Сl; г) Сl; д) +, Сl?
II уровень
1. Из предложенных ниже ответов выберите тот, который характеризует центральный ион и его заряд в соединении Cl 2: a) Zn 2+ ; б) NН 3 ; в) 2+ ; г) Сl; д) N -3 .
2. Какая из приведенных ниже формул соответствует сульфату тетраамминмеди (II):
a) SO 4 -H 2 O;
б) К ;
в) Cl 2 ;
г) SO 4 ;
д) SO 4 ?
3. Какие ионы образует при электролитической диссоциации в воде диакватетрагидроксоалюминат натрия Na :
a) Na + ; б) Аl, ОН", Na + ;
в) Na + , - ;
г) Na + , ОН";
д) Na + , - ?
За каждый правильный ответ (1 балл)
УЭ-4. Получение комплексных соединений
Частные дидактические цели:
1. На практике получить комплексные соединения, исследовать их свойства.
2. Записывать химические реакции в молекулярном и ионном виде.
3. Уметь составлять химические формулы комплексных соединений, называть комплексы.
Опыт № 1 . Растворение амфотерных гидроксидов в избытке щелочи.
К раствору сульфата алюминия по капле добавьте щелочь, получите осадок, затем растворите его в избытке щелочи.
1. Объясните результаты проведенных опытов.
2. Запишите уравнения проведённых реакций.
3. Какое пространственное строение комплексного иона?
К раствору хлорида цинка добавьте по каплям гидроксид калия до появления белого студенистого осадка гидроксида цинка. Разделите в две пробирки: в одну добавьте избыток КОН, а в другую - раствор аммиака. Что наблюдаете?
1. Составьте уравнения всех проведенных реакций.
2. Определите координационное число иона Zn 2+ , заряд комплексного иона, внешнюю сферу.
К раствору роданита калия (KCNS ) добавьте хлорид железа(III), получите красную кровяную соль, запишите её формулу, назовите полученный комплекс.
KCNS + FeCl 3 = ? + KCl роданит калия
1. Допишите уравнение проведенной реакции.
2. Запишите краткое ионное уравнение.
3. Каково пространственное строение комплексного иона?
За каждый правильно оформленный опыт Вы получаете по 2 балла.
Задание. Уравняйте методом электронного баланса или методом полуреакций окислительно-восстановительные реакции, каждое уравнение (3балла).
В настоящее время золото извлекают из руд цианидным методом предложенным князем Петром Романовичем Багратионом - племянником героя войны 1812 г.
Пример 1: Au + NaCN + H 2 O + O 2 -> Na + NaOH
Пример 2: Растворение золота в "царской водке".
Au + HNO 3 + HCl -> H + NO + H 2 O
УЭ-5. Практическое применение, значение комплексных соединений
Частные дидактические цели:
1. Ознакомиться с применением комплексных соединений.
2.Качественные реакции на ионы металлов.
3. Природные комплексы (хлорофилл и гемоглобин).
Руководство. Познакомьтесь с применением комплексных соединений.
Великий Гете сказал: "Просто знать - еще не все, знания нужно уметь использовать".
Ряд комплексных соединений применяют для распознавания тех или иных ионов.
Желтая кровяная соль (K 4 ) служит реагентом на катионы железа Fe, а красная кровяная соль (K 3 ) реагентом на катионы железа Fe.
Опыт №4. Качественная реакция на ионы Fe .
К раствору хлорида железа(Ш) прилейте 2-3 капли раствора желтой кровяной соли K 4 4K + + 4--
4Fe 3+ +3 4- -> Fe 4 3+ 3 4--
берлинская лазурь (темно-синий осадок)
Образуется темно-синий осадок берлинской лазури, или гексацианоферрата(П) железа(Ш). Берлинская лазурь была случайно получена в 1704 г. немецким мастером Дисбахом, готовившим краски для художников. В России ее применяли для окраски тканей, бумаги, в иконописи и при создании фресок.
Желтая кровяная соль (синильно-кислый поташ, синь-кали) - вещество ядовитое. Это соединение получали из животных отбросов (кровь, копыта, шкуры, сухая рыба, кожа, мясо, шерсть и другое), поэтому оно имеет такое название. Закупать ее в России можно было только с разрешения полиции.
Опыт №5 . Качественная реакция на ионы Fe 2+ .
К раствору сульфата железа(П) прильем несколько капель раствора красной кровяной соли K 3 . В растворе эта соль диссоциирует на ионы.
K 3 3K + з-
3Fe +2 = Fe 3 2
турнбулева синь
Образуется темно-синий осадок турнбулевой сини, или гексацианоферрата(Ш) железа(П). Турнбулева синь названа в честь Турнбуля (дед английского физика и химика У. Рамзая), владевшего заводом, на котором производились вещества, применяемые для крашения тканей.
Таким образом, соединения K 4 являются важными аналитическими реагентами соответственно на катионы Fe 3+ и Fe 2+ .
Вывод: комплексные соединения чрезвычайно разнообразны по составу и строению, поскольку может быть много различных комбинаций не только из разных, но и из одних и тех же компонентов.
УЭ-6.Свойства комплексных соединений
Цели: рассмотреть влияние строения комплексов на их свойства.
1) Изучение влияния строения иона металла на окраску комплексов
Разное количество d-электронов, разное координационное число, отсюда, разная окраска.
2) Сравнение интенсивности окраски комплексных соединений меди.

Окраска зависит от силы влияния частиц, т.е. лигандов во внутренней сфере, изменяется цвет.
3) Цвет комплексов зависит от природы и числа лигандов, окружающих центральный атом (катион).
Получено и широко используется на практике несколько комплексных соединений кобальта, которые имеют одинаковый качественный состав, но различаются числом и характером связи компонентов. Эти вещества входят в состав красителей (кобальтовые краски). Они по-разному окрашены:
Цвет комплексов зависит от природы и числа лигандов, окружающих центральный атом (катион).
УЭ-7. Резюме. Подведение итогов урока.
1.Прочитайте цели урока (УЭ-0).
2. Достигли ли цели урока?
3. К чему пришли в результате овладения темой.
УЭ-8. Контроль
I уровень
1. Определите внешнюю и внутреннюю сферу, заряд комплексного иона, диссоциация комплекса:
3.* Уравняйте методом полуреакции:
Zn + NaOH + H 2 O -> Na 2 + H 2
Be + KOH + H 2 O -> K 2 +H 2
Задача. Какой объем водорода выделится, если "растворить": 140 г цинка с 10% примесей? 36 г бериллия, при выходе водорода 70%(н.у.)
II уровень
1. Запишите диссоциацию, определите степень окисления центрального иона, координационное число, назовите соединения:
3*. Уравняйте методом полуреакции:
I вариант
а) Si + HNO 3 + HF -> H 2 + NO + H 2 O
Задача. Какая масса кремния с 20% примесей растворится, если выделилось 67,5 л оксида азота(II) (н.у.)?
II вариант
а) Cu + KCN + H 2 O -> K + KOH + H 2
б) Какой объем водорода выделится при выходе 60%, если растворили 69 г меди с 10% примесей?