1. Общие способы получения:
Окисление первичных спиртов и альдегидовпод действием различных окислителей:
Окисление алкановкислородом воздуха (в присутствии Мn 2+ или при нагревании под давлением). Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
Омыление сложных эфиров (т.е. их щелочной гидролиз):

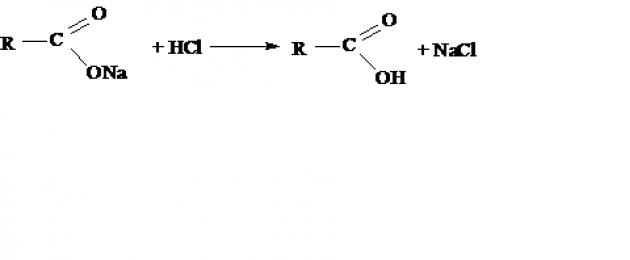
Гидролиз галогенангидридов кислот:

Сложные эфиры
Сложные эфиры – это производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на алкильный радикал; или это продукты замещения гидроксильного атома водорода в спиртах на кислотный радикал (ацил).
Номенклатура. Названия сложных эфиров образуются из названий соответствующих кислот или кислотных остатков и названий алкильных радикалов, входящих в состав спиртов:

метиловый эфир муравьиной кислоты амиловый эфир уксусной кислоты
(муравьинометиловый эфир, (уксусноамиловый эфир, амилацетат)
метилформиат)
Изомерия: 1) углеродного скелета; 2) межклассовая (изомерны карбоновым кислотам); 3) оптическая.
Физические свойства. Простейшие по составу сложные эфиры карбоновых кислот – бесцветные легкокипящие жидкости с фруктовым запахом; высшие сложные эфиры – воскообразные вещества (пчелиный воск), все сложные эфиры в воде растворяются плохо.
Химические свойства .
Гидролиз – важнейшее химическое свойство сложных эфиров:
этилпропионат
Для смещения реакции в сторону образования эфира можно «связать» образующуюся воду водоотнимающим средствам (например, конц. H 2 SO 4). В том случае, когда необходимо провести гидролиз эфира, реакцию иногда проводят в присутствии щелочи, которая позволяет «связать» образующуюся кислоту.
Жиры – это смесь сложных эфиров трехатомного спирта глицерина и высших карбоновых кислот (ВКК).
Общая формула жира:

где R, R 2 , R 3 – углеводородные радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
Впервые синтез жиров был осуществлен французским химиком М. Бертло в 1854 г. (реакция Бертло).
Номенклатура. По систематической номенклатуре жиры называют, добавляя окончание - инк названию кислоты и приставку, показывающую, сколько гидроксильных групп в молекуле глицерина проэтерифицировано.
Физические свойства. При комнатной температуре жиры (триглицериды) – вязкие жидкости или твердые вещества, легче воды; в воде не растворяются, но растворяются в органических растворителях (бензине, бензоле и др.).
Химические свойства.
I. Гидролиз . В зависимости от условий гидролиз бывает:
1. Водный(без катализатора, при высоких t 0 и Р);
Таблица 5 – Классификации жиров
2. Кислотный(в присутствии кислоты в качестве катализатора);
3. Ферментативный(происходит в живых организмах);
4. Щелочной(под действием щелочей).
II. Реакция присоединения (для жидких ненасыщенных жиров).
1. Присоединение водорода (гидрирование, гидрогенизация):

триолеин (жидкий жир) тристеарин (твердый жир)
2. Присоединение галогенов. Растительные масла обесцвечивают бромную воду:


9,10-гексабромтристеарин
Реакции окисления и полимеризации (для жидких ненасыщенных жиров). Жиры, содержащие остатки непредельных кислот (высыхающие масла), под действием кислорода воздуха окисляются и полимеризуются.
Получение жиров.
Основным способом синтеза жиров являются реакции этерификации глицерина с высшими карбоновыми кислотами.

Амины.
Амины – органические соединения, которые можно рассматривать как производные аммиака (NH 3), в молекуле которого один или несколько атомов водорода замещены углеводородными радикалами.
Гомологический ряд предельных аминов: СН 3 NH 2 – метиламин (первичный амин), (СН 3) 2 NH – диметиламин (вторичный амин), (СН 3) 3 N – триметиламин (третичный амин) и т.д.
Изомерия: 1) углеродного скелета; 2) положения аминогруппы (NH 2); 3) оптическая.
Физические свойства. Простейшие алифатические амины при нормальных условиях представляют собой газы или жидкости с низкой температурой кипения, обладающие резким запахом, характерным для аммиака. Они хорошо растворяются в воде. Амины являются полярными соединениями, для них характерно образование водородных связей, поэтому амины кипят при более высоких температурах чем соотвествующие алканы.
Химические свойства .
Будучи производными аммиака для аминов характерны химические свойства аммиака.
1. Взаимодействие с водой – образование гидроксидов замещенного аммония:
2. Взаимодействие с кислотами – образование солей
CH 3 NH 2 + НС1 = C1  + + Сl -
+ + Сl -
хлорид метиламмония
3. Горение аминов.
4. Первичные и вторичные амины реагируют с азотистой кислотой (первичные амины превращаются в спирты, вторичные – в N-нитрозамины):
RNH 2 + HNO 2 → ROH + N 2 + H 2 O,
R 2 NH + HNO 2 → R 2 N–NO + H 2 O.
Получение аминов.
1. Взаимодействие спиртов с аммиаком при нагревании в присутствии А1 2 O 3 в качестве катализатора:
R–OH + NH 3 → R – NH 2 + H 2 O.
2. Взаимодействие алкилгалогенидов (галогеналканов) с аммиаком, например:
CH 3 Br + 2NH 3 → CH 3 NH 2 + NH 4 Br
При избытке алкилгалогенида и аммиака:
CH 3 NH 2 + СН 3 Вr + NH 3 → (CH 3) 2 NH + NH 4 Br
диметиламин
Аминокислоты
Аминокислоты можно рассматривать как производные углеводородов, содержащие аминогруппы (–NH 2) и карбоксильные группы (–CООН).
Общая формула: (NH 2) m R(COOH) n ,
Номенклатура.

2-аминобутановая кислота
(α-аминобутановая)
Остатки около 20 различных α-аминокислот входят в состав белков.
Химические свойства. Аминокислоты являются полифункциональными соединениями. Вступают в реакции, характерные для аминов и карбновых кислот (см. химические свойства карбоновых кислот и аминов).
I. Амфотерные свойства.
1. Кислотные свойства (участвует карбоксильная группа):

глицин глицинат натрия (соль)
2. Основные свойства (участвует аминогруппа):

солянокислый глицин (соль)
II. Образование внутренних солей.
Моноаминомонокарбоновые кислоты (нейтральные кислоты):

внутренняя соль
(биполярный ион, или цвиттер-ион)
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН = 7). Водные растворы моноаминодикарбоновых кислот имеют рН < 7, так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н + . Водные растворы диаминомонокарбоновых кислот имеют рН > 7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН - .
III. Взаимодействие аминокислот друг с другом – образование пептидов.
Две аминокислоты образуют дипептид, три – трипептид, n - полипептид:

пептидная связь (амидная связь)
глицин аланин глицилаланин
При составлении названия дипептида сначала называют аминокислоту, у которой в образовании дипептида участвует группа –СООН. В тривиальном названии этой кислоты последняя буква «н» заменяется буквой «л». Затем прибавляют без изменений тривиальное название аминокислоты, у которой в образовании дипептида участвует группа –NH 2 .
Общая формула пептидов:
 Способы применения аминокислот:
Способы применения аминокислот:
1) аминокислоты широко распространены в природе;
2) молекулы аминокислот – это те кирпичики, из которых построены все растительные и животные белки; аминокислоты, необходимые для построения белков организма, человек и животные получают в составе белков пищи;
3) аминокислоты прописываются при сильном истощении, после тяжелых операций;
4) их используют для питания больных, минуя желудочно-кишечный тракт;
5) аминокислоты необходимы в качестве лечебного средства при некоторых болезнях (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты применяются в сельском хозяйстве для подкормки животных, что положительно влияет на их рост;
7) имеют техническое значение: аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна – капрон и энант.
22. Гетероциклические соединения.Азотосодержащие орг.соед….
Гетероциклические соединения - это органические соединения, содержащие в своих молекулах кольца (циклы), в образовании которых кроме атома углерода принимают участие и атомы других элементов. Атомы других элементов, входящие в состав гетероцикла, называются гетероатомами. Наиболее часто встречаются в составе гетероциклов гетероатомы азота, кислорода, серы, хотя могут существовать гетероциклические соединения с самыми различными элементами, имеющими валентность не менее двух.Гетероциклические соединения могут иметь в цикле 3, 4, 5, 6 и более атомов. Однако наибольшее значение имеют пяти- и шестичленные гетероциклы. Эти циклы, как и в ряду карбоциклических соединений, образуются наиболее легко и отличаются наибольшей прочностью. В гетероцикле может содержаться один, два и более гетероатомов.
Во многих гетероциклических соединениях электронное строение связей в кольце такое же, как и в ароматических соединениях. Поэтому типичные гетероциклические соединения условно обозначают не только формулами, содержащими чередующиеся двойные и одинарные связи, но и формулами, в которых сопряжение p -электронов обозначается кружком, вписанным в формулу.
Особенности азотсодержащих гетероциклических соединений:
1) среди азотсодержащих соединений особенно много веществ циклического строения;
2) наибольший интерес представляют те из них, где атомы азота входят в состав циклов наряду с углеродными атомами, как атомы кислорода – в циклические молекулы глюкозы, рибозы, дезоксирибозы;
3) соединения, содержащие циклы, в состав которых наряду с атомами углерода входят атомы других элементов, называются гетероциклическими (греч. «гетерос» – другой);
4) возможность существования разнообразных гетероциклов – еще одна из причин неисчерпаемого многообразия органических веществ.
Пиридин как вид азотсодержащего гетероциклического соединения. Его особенности:
1) это шестичленное гетероциклическое соединение с одним гетероатомом азота в цикле:
2) это бесцветная жидкость с неприятным запахом, хорошо растворимая в воде;
3) пиридин и его гомологи содержатся в каменноугольной смоле, которая и служит источником их получения;
4) на основании структурной формулы можно высказать двоякое суждение о свойствах пиридина;
5) наличие двойных связей в молекуле указывает на его высокую реакционноспособность, а сходство по строению с бензолом позволяет предположить, что вещество обладает большой химической способностью;
6) пиридин также имеет и много общего с бензолом по строению и свойствам.
В молекуле бензола каждый атом углерода, находясь в состоянии sр 2 -гибридизации, три электрона затрачивает на образование δ-связей и один электрон – на образование общего для молекулы π-облака (при боковом перекрывании облаков шести р-электронов). В молекуле пиридина одну группу СН заменяет атом азота, и он «поставляет» два электрона на установление δ-связей с двумя соседними углеродными атомами и один электрон – в систему π-облака, при этом, как и в молекуле бензола, образуется устойчивый секстет электронов. У атома азота остается после этого еще пара свободных электронов;
7) пиридин, как и бензол, устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании;
8) пиридин нитруется, реакция идет в более жестких условиях, чем у бензола, образуется нитропиридин.
Гетероциклическое соединение пиридин – это азотистое основание ароматического характера.
Способы применения пиридина: 1) ароматические и основные свойства пиридина используются при синтезе разного рода лекарственных препаратов, красителей, гербицидов; 2) также пиридин используется как растворитель для денатурирования этанола.

- 1. Общие и специфические способы получения карбоновых кислот.

1. Способы получения:
1. Окисление альдегидов и первичных спиртов - общий способ получения карбоновых кислот. В качестве окислителей применяются K М n О 4 и K 2 С r 2 О 7 .
R - CH 2 - OH → R - CH = O → R - CO - OH
спирт альдегид кислота

2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода - такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
- R-CCl 3 → [ R - C (OH) 3 ]→ R - COOH + Н 2 О

3. Получение карбоновых кислот из цианидов (нитрилов): дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:
- СН 3 -В r + NaCN → CH 3 - CN + NaBr .
метилцианид
Образующийся нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония:
- CH 3 CN + 2Н 2 О → CH 3 COONH 4 .
ацетат аммония
При подкислении раствора выделяется кислота:
- CH 3 COONH 4 + HCl → СН 3 СООН + NH 4 Cl .
уксусная кислота

Для отдельных кислот существуют специфические способы получения.
- Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
200 °С, Р H 2 SO 4
- NaOH + СО → HCOONa → НСООН
формиат натрия муравьиная кислота

- Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
2С 4 Н 10 + 5 O 2 → 4СН 3 СООН + 2Н 2 О.

- Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
5С 6 Н 5 -СН 3 + 6 KMnO 4 + 9 H 2 SO 4 = 5С 6 Н 5 СООН + 3 K 2 SO 4 + 6 MnSO 4 + 14 H 2 O .
- Бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро. В этой реакции бензальдегид обрабатывают 40-60 %-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и фенилметанола (бензилового спирта):

2. Важнейшие представители карбоновых кислот, их биологическая роль, способы получения, применение.
- Муравьиная кислота – бесцветная едкая жидкость с острым запахом, смешивающаяся с водой. Впервые выделена в Х VII в. из красных муравьев перегонкой с водяным паром. В природе встречается в свободном состоянии также в крапиве.
- Муравьиная кислота (HCOOH) - надежное оружие рыжих муравьев. Ядовитая железа такого муравья содержит от 20 до 70 % муравьиной кислоты, это главный компонент его «оборонного средства». Именно им муравьи парализуют добычу.
- Источники накопления муравьиной кислоты в атмосфере - выхлопные газы автомобилей и различные промышленные дымы, претерпевающие химические превращения под действием солнечных лучей.
- Получают муравьиную кислоту из гидроксида натрия и оксида углерода нагреванием под давлением (см. выше).

- Уксусная кислота (CH 3 COOH) – одно из первых органических соединений, которое было выделено в относительно чистом виде и описано уже в ХI в. алхимиками как продукт перегонки натурального уксуса.
- В 1845 г. немецкий химик А. Кольбе осуществил ее синтез. Водный раствор этой кислоты известен как столовый уксус. Безводная уксусная кислота затвердевает при температуре 17 ºС. Ее часто называют «ледяной» уксусной кислотой. Метод приготовления ледяной уксусной кислоты, вошедший в Российскую фармакопею, был разработан в 1784 г.

- Уксусная кислота представляет собой бесцветную жидкость с острым запахом и кислым вкусом, неограниченно смешивающуюся с водой.
- Безводную уксусную кислоту называют «ледяной», так как при 17 °С она замерзает и образует кристаллы, подобные льду. Обычная уксусная кислота, содержащая 2-3 % воды, замерзает при температуре ниже 13 °С.
- Уксусная кислота известна издавна. Ее разбавленные водные растворы образуются при брожении вина. При перегонке водных растворов получают приблизительно 80 %-ную кислоту («уксусную эссенцию»), которую применяют для пищевых целей.

- Синтетическую уксусную кислоту для нужд химической промышленности получают различными методами.
- Один из методов заключается в окислении уксусного альдегида, который, в свою очередь, получают из этилена окислением в присутствии РdСl 2 или из ацетилена.
- Второй метод заключается в карбонилировании метанола.
- Третий метод – каталитическое окисление бутана.

- Уксусную кислоту используют в качестве растворителя и как исходное вещество для синтеза производных уксусной кислоты (ацетилхлорида, ацетангидрида, амидов, сложных эфиров).
- Соли уксусной кислоты (ацетаты) применяют в текстильной промышленности в качестве протравителей и в синтезе как основные катализаторы.

- Пальмитиновая кислота ( C 16 H 32 O 2 , или CH 3 (CH 2 ) 14 COOH) – представляет собой бесцветное кристаллическое вещество со слабым запахом стеарина, в воде не растворяется. Широко распространена в природе, в виде сложных эфиров с глицерином входит в состав жиров.
- Получают пальмитиновую кислоту обработкой жиров щелочью (гидролиз, омыление). При этом образуются соли (пальмитаты), после подкисления которых осаждается сама кислота.
- Пальмитиновая кислота и ее производные используются в качестве поверхностно-активных веществ (моющих средств и др.). Ее натриевая соль называется мылом.

- Стеариновая кислота (C 18 H 36 O 2 , или CH 3 (CH 2 ) 16 COOH) – бесцветное кристаллическое вещество со слабым запахом стеарина. Ее эфиры с глицерином входят в состав жиров.
- Получают стеариновую кислоту омылением жиров. Обычно образуется смесь стеариновой и пальмитиновой кислот, которую можно разделить на составные части. Стеариновую кислоту в смеси с пальмитиновой используют в производстве свечей, их натриевые соли являются обыкновенным мылом. В органическом синтезе стеариновую кислоту используют для получения других поверхностно-активных веществ.
- Производные пальмитиновой и стеариновой кислот принадлежат к важным природным веществам – липидам.

- Акриловая кислота (CH 2 =CHCOOH) – бесцветная жидкость с острым запахом; t кип = 141 ºС.
- Во всех отношениях смешивается с водой, спиртом и эфиром.
- В промышленности ее получают из ацетилена:
C 2 H 2 + CO + H 2 О = С 2 Н з СООН.
- Соли акриловой кислоты используют как добавки к печатным краскам, пастам и некоторым лакам. В промышленности в больших количествах производят полимеры эфиров акриловой кислоты.

- Метакриловая кислота ( a-акриловая кислота, CH 2 C (CH 3 ) – СООН ) – бесцветная жидкость с резким запахом; растворима в воде и органических растворителях.
- Метакриловую кислоту получают присоединением синильной кислоты (HC N) к ацетону с последующей дегидратацией до лонитрила CH 2 C (CH 3)-C, которую подвергают омылению.
- Метакриловая кислота и ее производные применяют для получения технически важных полимерных продуктов, органического стекла, также используют в производстве каучуков, безосколочного стекла, ионообменных смол; соли полиметакриловой кислоты служат эмульгаторами.

- Олеиновая кислота ( CH 3 ( CH 2 ) 7 CH = CH ( CH 2 ) 7 COOH ) – одноосновная ненасыщенная карбоновая кислота; бесцветная вязкая жидкость.
- Олеиновая кислота в виде триглицерида содержится практически во всех растительных маслах и животных жирах.
- Получают кислоту главным образом из оливкового масла, в котором содержание ее достигает 70-85 %.
- Эфиры олеиновой кислоты применяют при получении лакокрасочных материалов, в производстве косметических препаратов, олеинового спирта и др.; сама кислота и некоторые ее эфиры используются в качестве пластификаторов - веществ, повышающих пластичность (например, в производстве резины).
- Соли олеиновой кислоты наряду с солями др. высших жирных кислот являются мылами.

- Линолевая кислота С 17 H 31 COOH, линоленовая кислота (CH 3 (CH 2 CH=CH) 3 (CH 2 )7COOH) – одноосновные с двумя и тремя изолированными двойными связями; бесцветные маслообразные жидкости.
- Линолевая кислота (арахидоновая кислота) и линоленовая кислота относятся к незаменимым жирным кислотам, необходимым для нормальной жизнедеятельности; в организм человека и животных эти кислоты поступают с пищей, главным образом в виде сложных липидов - триглицеридов и фосфатидов .
- В виде триглицерида кислоты в значительных количествах (до 40-60%) входят в состав многих масел растительных и животных жиров, например соевого, хлопкового, подсолнечного, льняного, конопляного масел, китового жира.

Урок поможет вам получить представление о теме «Химические свойства предельных одноосновных карбоновых кислот» (школьная программа по химии 10 класса). В ходе занятия вы узнаете про химические свойства предельных карбоновых кислот, которые обусловлены наличием в их молекуле карбоксиловой группы.
Тема: Карбонильные соединения. Карбоновые кислоты
Урок: Химические свойства предельных одноосновных карбоновых кислот
Из названия этих соединений можно предположить, что им характерны кислотные свойства.
Кислотные свойства
Кислотные свойства - способность к отщеплению иона водорода.
 ⇆ +H +
⇆ +H +
В чем проявляются кислотные свойства карбоновых кислот?
1. Наличие свободного иона водорода в растворах кислот обуславливает их кислый вкус и взаимодействие с индикаторами.

2. Кислоты взаимодействуют с активными металлами, выделяя водород:
2СН 3 СOOH + Mg →(СН 3 СOO) 2 Mg + H 2 .
этанат магния
(ацетат магния)
3. Реакции c основаниями:
СН 3 СOOH + NaOH → СН 3 СOONa + H 2 O.
4. Реакции с основными оксидами:
2СН 3 СOOH + ZnO → (СН 3 СOO) 2 Zn + H 2 O.
5. Реакции с солями более слабых кислот:
Электролит - вещество, диссоциирующее на ионы в растворе или расплаве.
Сильный электролит - электролит, диссоциирующий на ионы полностью.
Слабый электролит - электролит, диссоциирующий на ионы частично.
Карбоновые кислоты → слабые электролиты:
СН 3 СООН СН 3 СОО - + Н +

От чего зависит сила карбоновой кислоты?
1. От строения
Чем больше положительный заряд на атоме водорода в молекуле кислоты, тем более сильным электролитом она будет. Наличие электронодонорных углеводородных радикалов рядом с карбоксильной группой уменьшает способность кислоты диссоциировать.


2. От наличия других групп в молекуле
Введение электроноакцепторных заместителей увеличивает положительный заряд на атоме водорода и силу кислоты.


Нуклеофильное замещение (реакция этерификации)
Карбоновые кислоты взаимодействуют со спиртами в присутствии катализатора - серной кислоты, образуя сложные эфиры .
Декарбоксилирование - удаление карбоксильной группы.
1. При нагревании с твердыми щелочами соли карбоновых кислот дают алкан с числом атомов углерода на единицу меньше, а карбоксильная группа удаляется в виде карбоната:
RCOONa тв + NaOH тв RH + Na 2 CO 3 .
2. Твердые соли карбоновых кислот со щелочноземельными металлами при нагревании дают кетон и карбонат:
(СН 3 СОО) 2 Са СН 3 -СО-СН 3 + СаСО 3 .
3. Бензойная кислота при прокаливании разлагается на бензол и углекислый газ:
Ph-COOH PhH + CO 2 .
4. При электролизе водных растворов солей карбоновых кислот на аноде выделяется углекислый газ, а углеводородные радикалы объединяются в алкан (реакция Кольбе):
2RCOONa + Н 2 О → R-R + 2CO 2 + 2NaOH.
При электролизе без диафрагмы (с неразделенным катодным и анодным пространством) гидроксид натрия взаимодействует с углекислым газом, и одним из продуктов является гидрокарбонат:
2RCOONa + Н 2 О →R-R + 2NaHCO 3 .
Подведение итога урока
При помощи данного урока вы смогли самостоятельно изучить тему «Химические свойства предельных одноосновных карбоновых кислот» (школьная программа по химии 10 класса). В ходе занятия вы узнали химические свойства предельных карбоновых (органических) кислот, которые обусловлены наличием в их молекуле карбоксильной группы.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. - 4-е изд. - М.: РИА «Новая волна»: Издатель Умеренков, 2012. - 278 с.
Домашнее задание
1. №№ 2, 4 (с. 113) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Какие две кислоты имеют общую молекулярную формулу С 4 Н 8 О 2. Назовите их.
3. Какая из кислот монохлоруксусная или уксусная должна быть сильнее? Почему?
Карбоновые кислоты - органические кислоты. Они входят в состав живых организмов и участвуют в метаболизме. Химические свойства карбоновых кислот обуславливаются наличием карбоксильной группы -СООН. К ним относятся уксусная, муравьиная, щавелевая, масляная и ряд других кислот.
Общее описание
Существует несколько способов получения карбоновых кислот:
- окисление спиртов - C 2 H 5 OH + O2 → CH 3 COOH + H 2 O (из этанола образуется уксусная кислота);
- окисление альдегидов - CH 3 COH + [O] → CH 3 COOH;
- окисление бутана - 2C 4 H 10 + 5O 2 → 4CH 3 COOH + 2H 2 O;
- карбонилирование спирта - CH 3 + CO → CH 3 COOH;
- разложение щавелевой кислоты для получения муравьиной кислоты - C 2 H 2 O 4 → HCOOH + CO 2 ;
- взаимодействие солей с концентрированной серной кислотой - CH 3 COONa + H 2 SO 4 → CH 3 COOH + NaHSO 4 .

Рис. 1. Способы получения карбоновых кислот.
Физические свойства карбоновых кислот:
- температура кипения выше, чем у соответствующих углеводородов и спиртов;
- хорошая растворимость в воде - растворяются на катионы водорода и анионы кислотного остатка (являются слабыми электролитами);
- увеличение числа атомов углерода уменьшает силу кислот.
Карбоновые кислоты имеют прочные водородные связи (прочнее, чем у спиртов), что обуславливается высоким положительным зарядом на атоме водорода в карбоксильной группе.
Взаимодействие
Карбоновые кислоты изменяют окраску индикаторов. Лакмус и метилоранж становятся красными.

Рис. 2. Взаимодействие с индикаторами.
В таблице химических свойств карбоновых кислот описано взаимодействие кислот с другими веществами.
|
Реакции |
Результат |
Пример |
|
С металлами |
Выделяется водород, образуются соли |
2CH 3 COOH + Mg → (CH 3 COO) 2 Mg + H 2 |
|
С оксидами |
Образуются соль и вода |
2CH 3 COOH + ZnO → (CH 3 COO) 2 Zn + H 2 O |
|
С основаниями (нейтрализация) |
Образуются соль и вода |
CH 3 COOH + NaOH → CH 3 COONa + H 2 O |
|
С карбонатами |
Выделяются углекислый газ и вода |
2CH 3 COOH + CaCO 3 → (CH 3 COO) 2 Ca + H 2 O + CO 2 |
|
С солями слабых кислот |
Образуется неорганическая кислота |
2CH 3 COOH + Na 2 SiO 3 → 2CH 3 COONa + H 2 SiO 3 |
|
С аммиаком или гидроксидом аммония |
Образуется ацетат аммония. При взаимодействии с гидроксидом выделяется вода |
CH 3 COOH + NH 3 → CH 3 COONH 4 CH 3 COOH + NH 4 OH → CH 3 COONH 4 + H 2 O |
|
Со спиртами (этерификация) |
Образуются сложные эфиры |
CH 3 COOH + C 2 H 5 OH → CH 3 COOC 2 H 5 + H 2 O |
|
Галогенирование |
Образуется соль |
CH 3 COOH + Br 2 → CH 2 BrCOOH |
Соли, образующиеся при взаимодействии веществ с муравьиной кислотой, называются формиатами, с уксусной кислотой - ацетатами.
Декарбоксилирование
Отщепление карбоксильной группы называется процессом декарбоксилирования, который происходит в следующих случаях:
- при нагревании солей в присутствии твёрдых щелочей с образованием алканов - RCOONa тв + NaOH тв → RH + Na 2 CO 3 ;
- при нагревании твёрдых солей - (СН 3 СОО) 2 Са → СН 3 -СО-СН 3 + СаСО 3 ;
- при прокаливании бензойной кислоты - Ph-COOH → PhH + CO 2 ;
- при электролизе растворов солей - 2RCOONa + Н 2 О → R-R + 2CO 2 + 2NaOH.
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Число карбоксильных групп характеризует основность кислоты.
В зависимости от количества карбоксильных групп карбоновые кислоты подразделяются на одноосновные карбоновые кислоты (содержат одну карбоксильную группу), двухосновные (содержат две карбоксильные группы) и многоосновные кислоты.
В зависимости от вида радикала, связанного с карбоксильной группой, карбоновые кислоты делятся на предельные, непредельные и ароматические. Предельные и непредельные кислоты объединяют под общим названием кислоты алифатического или жирного ряда.
Одноосновные карбоновые кислоты
1.1 Гомологический ряд и номенклатура
Гомологический ряд одноосновных предельных карбоновых кислот (иногда их называют жирными кислотами) начинается с муравьиной кислоты
Формула гомологического ряда
Номенклатура ИЮПАК разрешает сохранять для многих кислот их тривиальные названия, которые обычно указывают на природный источник, из которого была выделена та или иная кислота, например, муравьиная, уксусная, масляная, валериановая и т.д.
Для более сложных случаев названия кислот производят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания -овая и слова кислота. Муравьиная кислота Н-СООН называется метановой кислотой, уксусная кислота СН 3 -СООН - этановой кислотой и т. д.
Таким образом, кислоты рассматриваются как производные углеводородов, одно звено которых превращено в карбоксил:

При составлении названий кислот с разветвленной цепью по рациональной номенклатуре их рассматривают как производные уксусной кислоты, в молекуле которой атомы водорода замещены радикалами, например, триметилуксусная кислота (СН 3) 3 С – СООН.
1.2 Физические свойства карбоновых кислот
Только с чисто формальных позиций можно рассматривать карбоксильную группу как комбинацию карбонильной и гидроксильной функций. Фактически их взаимное влияние друг на друга таково, что полностью изменяет их свойства.
Обычная для карбонила поляризация двойной связи С=0 сильно возрастает за счет дополнительного стягивания свободной электронной пары с соседнего атома кислорода гидроксильной группы:

Следствием этого является значительное ослабление связи О-Н в гидроксиле и легкость отщепления атома водорода от него в виде протона (Н +). Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С-С к карбоксильной группе и появлению (как у альдегидов и кетонов) пониженной электронной плотности (δ +) на α-углеродном атоме кислоты.
Все карбоновые кислоты обладают кислой реакцией (обнаруживается индикаторами) и образуют соли с гидроксидами, оксидами и карбонатами металлов и с активными металлами:
Карбоновые кислоты в большинстве случаев в водном растворе диссоциированы лишь в малой степени и являются слабыми кислотами, значительно уступая таким кислотам, как соляная, азотная и серная. Так, при растворении одного моля в 16 л воды степень диссоциации муравьиной кислоты равна 0,06, уксусной кислоты - 0,0167, в то время как соляная кислота при таком разбавлении диссоциирована почти полностью.
Для большинства одноосновных карбоновых кислот рК а = 4,8, только муравьиная кислота имеет меньшую величину рК а (около 3,7), что объясняется отсутствием электронодонорного эффекта алкильных групп.
В безводных минеральных кислотах карбоновые кислоты протонируются по кислороду с образованием карбкатионов:

Сдвиг электронной плотности в молекуле недиссоциированной карбоновой кислоты, о котором говорилось выше, понижает электронную плотность на гидроксильном атоме кислорода и повышает ее на карбонильном. Этот сдвиг еще больше увеличивается в анионе кислоты:

Результатом сдвига является полное выравнивание зарядов в анионе, который фактически существует в форме А - резонанс карбоксилат-аниона.
Первые четыре представителя ряда карбоновых кислот - подвижные жидкости, смешивающиеся с водой во всех отношениях. Кислоты, в молекуле которых содержится от пяти до девяти атомов углерода (а также изомасляная кислота), - маслянистые жидкости, растворимость их в воде невелика.
Высшие кислоты (от С 10) - твердые тела, практически нерастворимы в воде, при перегонке в обычных условиях они разлагаются.
Муравьиная, уксусная и пропионовая кислоты имеют острый запах; средние члены ряда обладают неприятным запахом, высшие кислоты запаха не имеют.

На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты образуют прочные водородные связи, так как связи О-Н в них сильно поляризованы. Кроме того, карбоновые кислоты способны образовывать водородные связи с участием атома кислорода карбонильного диполя, обладающего значительной электроотрицательностью. Действительно, в твердом и жидком состоянии карбоновые кислоты существуют в основном в виде циклических димеров:
Такие димерные структуры сохраняются в некоторой степени даже в газообразном состоянии и в разбавленных растворах в неполярных растворителях.