Внутренняя энергия системы может изменяться в результате теплообмена. Т.е., если к системе подводится теплота в количестве dQ, а работа не производится dW = 0, то согласно I закона термодинамики
dU = dQ – dW = dQ
Теплота - способ изменения внутренней энергии системы без изменения внешних параметров (dV = 0 ® dW = 0), это микроскопический способ преобразования энергии.
При поглощении системой некоторого количества теплоты dQ внутренняя энергия ее увеличивается на величину dU (согласно формуле (6.32.)). Возрастание внутренней энергии ведет к увеличению интенсив-ности движения частиц, составляющих систему. Согласно выводам статистической физики средняя скорость движения молекул связана с температурой
Т.е. поглощение системой некоторого количества теплоты dQ ведет к увеличению температуры системы на величину dT, пропорциональную dQ.
dT = const . dQ (6.33)
Соотношение (6.33) можно переписать в другом виде:
dQ = C . dT или , (6.34)
где С – константа, называемая теплоемкостью системы.
Итак, теплоемкость – это количество теплоты, необходимое для нагревания термодинамической системы на один градус по шкале Кельвина.
Теплоемкость системы зависит от:
а) состава и температуры системы;
б) размера системы;
в) условий, при которых происходит переход теплоты.
 |

Схема 6.6. Виды теплоемкости
Т.е. С (теплоемкость), как и Q, является функцией процесса, а не состояния и относится к экстенсивным параметрам.
По количеству нагреваемого вещества различают:
1) удельную теплоемкость С уд, отнесенную к 1 кг или 1 г вещества;
2) молярную (мольную) теплоемкость С м, отнесенную к 1 моль вещества.
Размерность {С уд } = Дж/г. К
{С м } = Дж/моль. К
Между удельной и молярной теплоемкостями имеется соотношение
С м = С уд. М, (6.35)
где М – молярная масса.
При описании физико-химических процессов обычно пользуются молярной теплоемкостью С м (в дальнейшем индекс писать не будем).
Различают также среднюю и истинную теплоемкости.
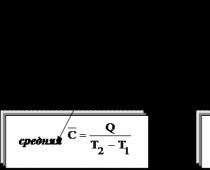
Средняя теплоемкость – это отношение некоторого количества теплоты к разности температур
 (6.36)
(6.36)
Истинной теплоемкостью С называют отношение бесконечно малого количества теплотыdQ, которое нужно подвести к одному моль вещества, к бесконечно малому приращению температуры – dT.
Установим связь между истинной и средней теплоемкостями.
Во-первых,
Во-вторых, выразим Q из формулы (6.36) ![]() (6.37). С другой стороны из формулы (6.34) ® dQ = CdT (6.38). Проинтегрируем (6.38) в интервале T 1 - T 2 и получим
(6.37). С другой стороны из формулы (6.34) ® dQ = CdT (6.38). Проинтегрируем (6.38) в интервале T 1 - T 2 и получим
Приравняем правые части выражений (6.37) и (6.39)

Отсюда  (6.40)
(6.40)
Это уравнение связывает среднюю теплоемкость с истинной С.
Среднюю теплоемкость рассчитывают в интервале температур от Т 1 до Т 2 . Нередко интервал выбирают от ОК до Т, т.е. нижний предел Т 1 = ОК, а верхний имеет переменное значение, т.е. от определенного интервала перейдем к неопределенному. Тогда уравнение (6.40) примет вид:
Расчет можно провести графически, если известны значения истинной теплоемкости при нескольких температурах. Зависимость С = f(T) представлена кривой АВ на рис. 1.
 |
Рис. 6.7. Графическое определение средней теплоемкости
Интеграл в выражении (6.40) представляет собой площадь фигуры Т 1 АВТ 2 .
Таким образом, измерив площадь, определяем
 (6.42)
(6.42)
Рассмотрим значение теплоемкости системы при некоторых условиях:
Согласно I закону термодинамики dQ V = dU. Для простых систем внутренняя энергия является функцией объема и температуры U = U (V,T)

Теплоемкость в этих условиях
 (6.43)
(6.43)
dQ p = dH. Для простых систем H = H(p,T);

Теплоемкость
 (6.44)
(6.44)
С р и С V - теплоемкости при постоянных p и V.
Если рассматривать 1 моль вещества т.е. С р и С V - молярные теплоемкости
dQ V = C V dT, dQ p = C p dT (6.45)
Для «n» моль вещества dQ V = nC V dT, dQ p = nC p dT
Исходя из выражения (6.45), находим
 (6.46)
(6.46)
Зная зависимость теплоемкости вещества от температуры, по формуле (6.46) можно вычислить изменение энтальпии системы в интервале Т 1 ¸Т 2 . В качестве базовой температуры выбирается Т 1 = ОК или 298,15 К. В этом случае разность энтальпий Н(Т) – Н(298) называется высокотемпературной составляющей энтальпии.
Найдем связь между С р и С V . Из выражений (6.43) и (6.44) можно записать:


Из I закона термодинамики с учетом только механической работы для простой системы, для которой U = U(V,T)
dQ = dU + pdV = 
т.е.  (6.49)
(6.49)
Подставим dQ из выражения (6.46) в (6.48) и (6.49) и получим:
Для простой системы объем можно рассматривать как функцию давления и температуры, т.е.
V = V(p,T) ® dV = 
при условии p = const dp = 0, 
т.е. 
Отсюда  ,
,
Таким образом  (6.51)
(6.51)
Для 1 моль идеального газа pV = RT,
 C p – C V =
C p – C V =
Для 1 моль реального газа и применение уравнения Ван-дер-Ваальса приводит к следующему выражению:
C p – C V = 
Для реальных газов С p – C V > R. Эта разность увеличивается по мере увеличения давления, т.к. с увеличением давления растет , связанное со взаимодействием молекул реального газа друг с другом.
Для твердого тела при обычной температуре С p – C V < R и составляет примерно 1 Дж/(моль. К). с понижением температуры разность С p – C V уменьшается и при Т ® ОК С p – C V ® 0.
Теплоемкость обладает свойством аддитивности, т.е. теплоемкость смеси двух веществ
 (6.52)
(6.52)
В общем случае
 ,
,
где x i - доля веществ «I» в смеси.
Теплоемкость является одной из важнейших термодинамических характеристик индивидуальных веществ.
В настоящее время имеются точные методы измерения теплоемкости в широком интервале температур. Достаточно удовлетворительно разработана теория теплоемкости для простого твердого вещества при невысоких давлениях. Согласно молекулярно-кинетической теории теплоемкости для одного моль газа на каждую степень свободы приходится R/2. Т.е. поскольку молярная теплоемкость идеального газа при постоянном объеме
C V = C n + C в + C к + С э, (6.53)
где C n – теплоемкость газа, связанная с поступательным движением молекул,
С в – с вращательным,
С к – с колебательным,
а С э – с электронными переходами, то для одноатомного идеального газа С V = 3/2R,
для двухатомных и линейных трехатомных молекул
C V = 5/2R + C к
для нелинейных многоатомных молекул
C V = 3R + С к
Теплоемкость С к, связанная с колебательным движением атомов в молекуле, подчиняется законам квантовой механики и не отвечает закону равномерного распределения энергии по степеням свободы.
С э в формуле (6.53) не принимается во внимание, С э – это теплоемкость, связанная с электронными переходами в молекуле. Переход электронов на более высокий уровень под действием теплообмена возможен лишь при температурах выше 2000 К.
Теплоемкость твердых веществ с атомной кристаллической решет-кой можно вычислить по уравнению Дебая:
C V = C Д (х), ![]() ,
,
где q – характеристическая температура;
n m – максимальная характеристическая частота колебания атомов в молекуле.
При повышении температуры C V твердых веществ с атомной кристаллической решеткой стремится к предельному значению C V ® 3R. При очень низких температурах
C V ~ T 3 (T < q/12).
Теплоемкости С р по опытным значениям C V (или наоборот) для веществ с атомной кристаллической решеткой можно рассчитать по уравнению:
C p = С V (1 + 0,0214C V )
Для сложного твердого или жидкого вещества хорошей теории пока не существует. Если экспериментальные данные по теплоемкости отсутствуют, то ее можно оценить с помощью эмпирических правил
1) Правило Дюлонга и Пти: атомная теплоемкость при постоянном объеме для любого простого твердого вещества приблизительно равна 25 Дж/(моль. К)
Правило выполняется при высоких температурах (близких к температуре плавления твердого вещества) для элементов, атомная масса которых больше, чем у калия. Как показал Больцман, оно может быть качественно обосновано кинетической теорией:
C V » 25 Дж/(моль. К)(3R)
2) Правило Неймана-Коппа (правило аддитивности) основывается на предположении о неизменяемости теплоемкости элементов при образовании химических связей
С св-ва = 25n
где n – число атомов, входящих в молекулу.
Более близкие к экспериментальным значениям теплоемкости получаются по правилу Неймана-Коппа, если принять для легких элементов значения атомных теплоемкостей представленные в табл. 6.1.
Таблица 6.1.
Значения атомных теплоемкостей для легких элементов
Для остальных элементов C p 0 » 25,94 Дж/(моль. К).
3) Правило аддитивности лежит в основе формулы Келли, которая справедлива для высококипящих чистых неорганических жидкостей (BeO, BeCl 2 , MgBr 2 и др.):
где n – число атомов в молекуле, входящих в молекулу неорганического вещества.
У расплавленных элементов с d- и f-электронами С ат достигает 42¸50 Дж/(моль. К).
4) Приближенный метод расчета для органических жидкостей, использующий атомно-групповые составляющие теплоемкостей
![]()
Последние получены при анализе опытных данных большого числа соединений, некоторые из которых сведены в табл. 6.2.
Таблица 6.2.
Некоторые значения атомно-групповых составляющих теплоемкостей
| Атом или группа | С р, Дж/(моль. К) | Атом или группа | С р, Дж/(моль. К) |
| –СН 3 | 41,32 | –О– | 35,02 |
| –СН 2 – | 26,44 | –S– | 44,35 |
| СН– | 22,68 | –Cl | 35,98 |
| –СN | 58,16 | –Br | 15,48 |
| –ОН 2 | 46,02 | C 6 H 5 – | 127,61 |
| С=О(эфиры) | 60,75 | –NH 2 (амины) | 63,6 |
| С=О(кетоны) | 61,5 | –NO 2 | 64,02 |
Зависимость теплоемкости от температуры
Теплоемкость твердых, жидких и газообразных веществ повышается с температурой. Только теплоемкости одноатомных газов практически не зависят от Т (например, He, Ar и другие благородные газы). Наиболее сложная зависимость С(Т) наблюдается у твердого вещества. Зависимость С(Т) изучается экспериментально, т.к. теория недостаточно разработана.
Обычно зависимость атомной и молярной теплоемкости от температуры выражается в виде интерполяционных уравнений.
С р = а + в. Т + с. Т 2 (для органических веществ) (6.53)
С р = а + в. Т + с / . Т -2 (для неорганических веществ)
Коэффициенты а, в, с, с / - постоянные величины, характерные для данного вещества вычисляются на основании экспериментальных данных и справедливы в определенном интервале температур.
Это количество теплоты, которое необходимо сообщить системе для увеличения ее температуры на 1 (К ) при отсутствии полезной работы и постоянстве соответствующих параметров.
Если в качестве системы мы берем индивидуальное вещество, то общая теплоемкость системы равняется теплоемкости 1 моль вещества () умноженное на число моль ().
Теплоемкость может быть удельная и молярная.
Удельная теплоемкость - это количество теплоты, необходимое для нагревания единицы массы вещества на 1 град (интенсивная величина).
Молярная теплоемкость - это количество теплоты, необходимое для нагревания одного моль вещества на 1 град .
Различают истинную и среднюю теплоемкость.
В технике обычно используют понятие средней теплоемкости.
Средняя - это теплоемкость для определенного интервала температур.
Если системе, содержащей количество вещества или массой , сообщили количество теплоты , а температура системы повысилась от до , то можно рассчитать среднюю удельную или молярную теплоемкость:
Истинная молярная теплоемкость - это отношение бесконечно малого количества теплоты, сообщенной 1 моль вещества при определенной температуре, к приращению температуры, которое при этом наблюдается.
Согласно уравнению (19), теплоемкость, как и теплота, не является функцией состояния. При постоянном давлении или объеме, согласно уравнениям (11) и (12), теплота, а, следовательно, и теплоемкость приобретают свойства функции состояния, то есть становятся характеристическими функциями системы. Таким образом, получаем изохорную и изобарную теплоемкости.
Изохорная теплоемкость - количество теплоты, которое необходимо сообщить системе, чтобы повысить температуру на 1 , если процесс происходит при .
Изобарная теплоемкость - количество теплоты, которое необходимо сообщить системе, чтобы повысить температуру на 1 при .
Теплоемкость зависит не только от температуры, но и от объема системы, поскольку между частицами существуют силы взаимодействия, которые изменяются при изменении расстояния между ними, поэтому в уравнениях (20) и (21) используют частные производные.
Энтальпия идеального газа, как и его внутренняя энергия, является функцией только температуры:
а в соответствии с уравнением Менделеева-Клапейрона , тогда
Поэтому для идеального газа в уравнениях (20), (21) частные производные можно заменить на полные дифференциалы:
Из совместного решения уравнений (23) и (24) с учетом (22), получим уравнение взаимосвязи между и для идеального газа.
Разделив переменные в уравнениях (23) и (24), можно рассчитать изменение внутренней энергии и энтальпии при нагревании 1 моль идеального газа от температуры до
Если в указанном интервале температур теплоемкость можно считать постоянной, то в результате интегрирования получаем:
Установим взаимосвязь между средней и истинной теплоемкостью. Изменение энтропии с одной стороны выражается уравнением (27), с другой -
Приравняв правые части уравнений и выразив среднюю теплоемкость, имеем:
Аналогичное выражение можно получить для средней изохорной теплоемкости.
Теплоемкость большинства твердых, жидких и газообразных веществ повышается с ростом температуры. Зависимость теплоемкости твердых, жидких и газообразных веществ от температуры выражается эмпирическим уравнением вида:
где а , b , c и - эмпирические коэффициенты, вычисленные на основе экспериментальных данных о , причем коэффициент относится к органическим веществам, а - к неорганическим. Значения коэффициентов для различных веществ приведены в справочнике и применимы только для указанного интервала температур.
Теплоемкость идеального газа не зависит от температуры. Согласно молекулярно-кинетической теории теплоемкость, приходящаяся на одну степень свободы, равна (степень свободы - число независимых видов движения на которые можно разложить сложное движение молекулы). Для одноатомной молекулы характерно поступательное движение, которое можно разложить на три составляющие в соответствии с тремя взаимно перпендикулярными направлениями по трем осям. Поэтому изохорная теплоемкость одноатомного идеального газа равна
Тогда изобарная теплоемкость одноатомного идеального газа согласно (25) определится по уравнению
Двухатомные молекулы идеального газа помимо трех степеней свободы поступательного движения имеют и 2 степени свободы вращательного движения. Следовательно .
– это количество теплоты, подведенное к 1 кг вещества при изменении его температуры от Т 1 до Т 2 .
1.5.2. Теплоемкость газов
Теплоемкость газов зависит от:
типа термодинамического процесса (изохорный, изобарный, изотермический и др.);
рода газа, т.е. от числа атомов в молекуле;
параметров состояния газа (давления, температуры и др.).
А) Влияние типа термодинамического процесса на теплоемкость газа
Количество теплоты, необходимое для нагревания одного и того же количества газа в одном и том же диапазоне температур, зависит от типа термодинамического процесса, совершаемого газом.
|
|
В изобарном процессе (р = const) теплота тратится не только на нагрев газа на ту же величину, что и в изохорном процессе, но и на совершение им работыпри поднятии поршня с площадьюна величину(рис. 1.2б ). Теплоемкость газа в изобарном процессе обозначается символом с р .
Так как по условию в обоих процессах величина одинакова, то в изобарном процессе за счет совершения газом работывеличина. Поэтому в изобарном процессе теплоемкостьс р с υ .
В соответствии с формулой Майера для идеального газа
или . (1.6)
Б) Влияние рода газа на его теплоемкость Из молекулярно-кинетической теории идеального газа известно, что
где – число поступательных и вращательных степеней свободы движения молекул данного газа. Тогда
![]() ,
а
,
а
![]() .
(1.7)
.
(1.7)
Одноатомный газ имеет три поступательных степени свободы движения молекулы (рис.1.3а ), т.е. .
Двухатомный газ имеет три поступательных степени свободы движения и две степени свободы вращательного движения молекулы (рис. 1.3б ), т.е. . Аналогично можно показать, что для трехатомного газа.
Таким образом, мольная теплоемкость газов зависит от числа степеней свободы движения молекул, т.е. от числа атомов в молекуле , а удельная теплоемкость зависит также от молекулярной массы, т.к. от неё зависит значение газовой постоянной, которая различна для разных газов.
В) Влияние параметров состояния газа на его теплоемкость
Теплоемкость идеального газа зависит только от температуры и увеличивается при увеличении Т .
Одноатомные газы представляют исключение, т.к. их теплоемкость практически не зависит от температуры.
Классическая молекулярно-кинетическая теория газов позволяет довольно точно определить теплоемкости одноатомных идеальных газов в широком диапазоне температур и теплоемкости многих двухатомных (и даже трехатомных) газов при невысоких температурах.
Но при температурах, существенно отличных от 0 о С, экспериментальные значения теплоемкости двух- и многоатомных газов оказываются значительно отличающимися от предсказанных молекулярно-кинетической теорией.
В теплотехнических расчетах обычно пользуются опытными значениями теплоемкости газов, представленными в виде таблиц. При этом теплоемкость, определенная в опыте (при данной температуре), называется истинной теплоемкостью. А если в опыте измерялось количество теплоты q , которое было затрачено на существенное повышение температуры 1 кг газа от некоторой температуры T 0 до температуры T , т.е. на Т = Т T 0 , то отношение
называется средней теплоемкостью газа в данном интервале температур.
Обычно в справочных таблицах значения средней теплоемкости даются при значении T 0 , соответствующем нулю градусов Цельсия.
Теплоемкость реального газа зависит, кроме температуры, также и от давления из-за влияния сил межмолекулярного взаимодействия.
Учитывая, что теплоемкость непостоянна, а зависит от температуры и других термических параметров, различают истинную и среднюю теплоемкости. Истинная теплоемкость выражается уравнением (2.2) при определенных параметрах термодинамического процесса, то есть в данном состоянии рабочего тела. В частности, если хотят подчеркнуть зависимость теплоёмкости рабочего тела от температуры, то записывают её как , а удельную – как. Обычно под истинной теплоёмкостью понимают отношение элементарного количества теплоты, которое сообщается термодинамической системе в каком-либо процессе к бесконечно малому приращению температуры этой системы, вызванному сообщенной теплотой. Будем считатьистинной теплоёмкостью термодинамической системы при температуре системы равной, а- истинной удельной теплоёмкостью рабочего тела при его температуре равной. Тогда среднюю удельную теплоёмкость рабочего тела при изменении его температуры отдоможно определить как
|
|
Обычно в таблицах приводятся средние значения теплоемкости для различных интервалов температур, начинающихся с. Поэтому во всех случаях, когда термодинамический процесс проходит в интервале температур отдо, в котором, количество удельной теплотыпроцесса определяется с использованием табличных значений средних теплоемкостейследующим образом:
|
|
Значения средних теплоемкостей и, находят по таблицам.
2.3.Теплоёмкости при постоянном объёме и давлении
Особый интерес представляют средние и истинные теплоемкости в процессах при постоянном объеме (изохорная теплоемкость , равная отношению удельного количества теплоты в изохорном процессе к изменению температуры рабочего тела dT) и при постоянном давлении(изобарная теплоемкость , равная отношению удельного количества теплоты в изобарном процессе к изменению температуры рабочего тела dT).
Для идеальных газов связь между изобарной и изохорной теплоёмкостями и устанавливается известным уравнением Майера .
Из уравнения Майера следует, что изобарная теплоемкость больше изохорной на значение удельной характеристической постоянной идеального газа. Это объясняется тем, что в изохорном процессе () внешняя работа не выполняется и теплота расходуется только на изменение внутренней энергии рабочего тела, тогда как в изобарном процессе () теплота расходуется не только на изменение внутренней энергии рабочего тела, зависящей от его температуры, но и на совершение им внешней работы.
Для реальных газов , так как при их расширении исовершается работа не только против внешних сил, но и внутренняя работа против сил взаимодействия между молекулами газа, на что дополнительно расходуется теплота.
В теплотехнике широко применяется отношение теплоемкостей , которое носит название коэффициента Пуассона (показателя адиабаты). В табл. 2.1 приведены значениянекоторых газов, полученные экспериментально при температуре 15 °С.
Теплоемкости изависят от температуры, следовательно, и показатель адиабатыдолжен зависеть от температуры.
Известно, что с повышением температуры теплоёмкость увеличивается. Поэтому с ростом температурыуменьшается, приближаясь к единице. Однако всегда остается больше единицы. Обычно зависимость показателя адиабаты от температуры выражается формулой вида
и так как
Теплоемкость является функцией параметров состояния – давления и температуры, поэтому в технической термодинамике различают истинную и среднюю теплоемкости.
Теплоемкость идеального газа зависит только от температуры и по определению может быть найдена лишь в интервале температур . Однако всегда можно предположить, что этот интервал очень мал вблизи какого-либо значения температуры. Тогда можно сказать, что теплоемкость определена при данной температуре. Такая теплоемкость называется истинной.
В справочной литературе зависимость истинных теплоемкостей с р и с v от температуры задают в виде таблиц и аналитических зависимостей. Аналитическую зависимость (например, для массовой теплоемкости) обычно представляют в виде полинома:
![]()
Тогда количество подведенной в процессе теплоты в интервале температур [t 1 ,t 2 ] определяется интегралом:
![]() . (2)
. (2)
При исследовании термодинамических процессов часто определяют среднее в интервале температур значение теплоемкости. Она представляет собой отношение количества подведенной в процессе теплоты Q 12 к конечной разности температур:
Тогда, если задана зависимость истинной теплоемкости от температуры, в соответствии с (2):
![]() .
.
Часто в справочной литературе приводят значения средних теплоемкостей с р и с v для интервала температур от 0 доt о С . Как и истинные, их представляют в виде таблиц и функций:
![]() (4)
(4)
При подстановке значения температуры t в эту формулу будет найдена средняя теплоемкость в интервале температур [0,t ]. Чтобы найти среднее значение теплоемкости в произвольном интервале [t 1 ,t 2 ], пользуясь зависимостью (4), нужно найти количество теплоты Q 12 , подведенной к системе в этом интервале температур. На основании известного из математики правила интеграл в уравнении (2) может быть разбит на следующие интегралы:
 .
.
 , а
, а  .
.
После этого искомое значение средней теплоемкости находят по формуле (3).
Газовые смеси
В технике в качестве рабочих тел чаще используются не чистые вещества, а смеси различных газов. Под газовой смесью в данном случае понимают механическую смесь чистых веществ, называемых компонентами смеси , не вступающих друг с другом в химические реакции. Примером газовой смеси является воздух, основными компоненты которого являются кислород и азот. Если компонентами смеси являются идеальные газы, то и смесь в целом также будем считать идеальным газом.
При рассмотрении смесей предполагается, что:
Каждый газ, входящий в состав смеси, равномерно распределён по всему объёму, то есть его объём равен объёму всей смеси;
Каждый из компонентов смеси имеет температуру, равную температуре смеси;
Каждый газ создаёт своё давление на стенки сосуда, называемое парциальным давлением.
Парциальное давление , таким образом, это давление, которое имел бы компонент смеси, если бы он один занимал весь объем смеси при той же температуре. Сумма парциальных давлений каждого компонента равна давлению смеси (закон Дальтона):
![]() .
.
Парциальным объёмом компонента V называется такой объём, который занимал бы данный компонент при давлении, равном давлению смеси, и температуре, равной температуре смеси. Очевидно, что сумма парциальных объемов равна объему смеси (закон Амага):
![]() .
.
При исследовании термодинамических процессов с газовыми смесями необходимо знать ряд характеризующих их величин: газовую постоянную, молярную массу, плотность, теплоемкость и т.д. Для их нахождения должен быть задан состав смеси , определяющий количественное содержание каждого компонента, входящего в смесь. Состав газовой смеси обычно задают массовыми , объёмными или мольными долями.
Массовой долей компонента смеси g называется величина, равная отношению массы компонента к массе всей смеси:
Очевидно, что масса смеси m равна сумме масс всех компонентов:
![]() ,
,
а сумма массовых долей:
Объемной долей компонента смеси r i называется величина, равная отношению парциального объема компонента к объему смеси:
Уравнение объёмного состава смеси имеет вид:
![]()
и сумма объемных долей:
Мольной долей компонента смеси х i называется величина, равная отношению числа молей этого компонента к общему числу молей смеси:
Очевидно, что:
Состав смеси задают долями единицы или в процентах. Связь между мольными и объемными долями можно установить, записывая уравнение Клапейрона – Менделеева для компонента смеси и всей смеси:
Поделив почленно первое уравнение на второе, получим:
Таким образом, для идеальных газов объемные и мольные доли оказываются равными.
Связь между массовыми и объёмными долями устанавливается соотношениями:
![]() . (5)
. (5)
Из закона Авогадро следует:
где μ – молярная масса смеси, которую называют кажущейся . Она может быть найдена, в частности, через объемный состав смеси. Записывая уравнение Клапейрона – Менделеева для i-го компонента смеси в виде
![]()
и суммируя по всем компонентам, получим:
![]() .
.
Сравнивая его с уравнением состояния для смеси в целом
приходим к очевидному соотношению:
 .
.
Если найдена молярная масса смеси, газовая постоянная смеси может быть определена обычным способом:
![]() . (7)
. (7)
Этими формулами пользуются при определении истинных и средних теплоемкостей смеси.